
科目: 来源: 题型:解答题
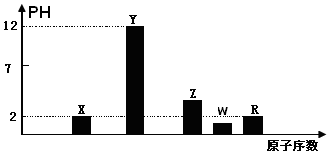


查看答案和解析>>
科目: 来源: 题型:解答题
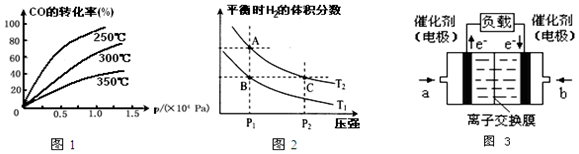
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,V(正)>V(逆) | |
| B. | 相同温度下,起始时向容器中充入2mol SO3,达平衡时SO3的转化率为20% | |
| C. | 平衡混合气体中SO2的物质的量为1.2mol | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收39.2kJ的热量 |
查看答案和解析>>
科目: 来源: 题型:选择题
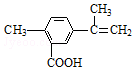
| A. | 在一定条件下,能发生取代、氧化、水解、酯化和加聚反应 | |
| B. | 该物质分子中最多可以有9个碳原子在同一平面上 | |
| C. | 1 mol该物质最多可与5mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
查看答案和解析>>
科目: 来源: 题型:选择题
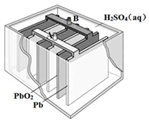 铅蓄电池是最常见的二次电池,其构造示意图如下.发生反应的化学方程式为:
铅蓄电池是最常见的二次电池,其构造示意图如下.发生反应的化学方程式为:| A. | 放电时,电解质溶液的PH值增大 | |
| B. | 放电时,电路中转移0.2mol电子时Pb电极质量减少20.7g | |
| C. | 放电时,溶液中H+向PbO2电极移动 | |
| D. | 放电时,正极反应为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-═PbSO4(s)+2H2O(l) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向水中加入少量Na固体,平衡逆向移,c(H+)降低 | |
| B. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| C. | 向水中加入少量硫酸氢钠固体,c(H+)增大,Kw不变动 | |
| D. | 将水加热,Kw增大,pH不变 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
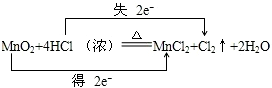 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com