
科目: 来源: 题型:选择题
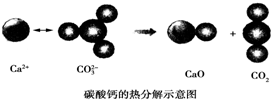
| A. | CO2(g)和CaO(s)的总能量大于CaCO3(s)的总能量 | |
| B. | 由该反应可推出凡是需要加热才发生的反应均为吸热反应 | |
| C. | 该反应的焓变大于零 | |
| D. | 该反应中有离子键断裂也有共价键断裂,化学键断裂吸收能量,化学键生成放出能量 |
查看答案和解析>>
科目: 来源: 题型:解答题
| Fe2O3 | CO | Fe | CO21 | |
| 甲/mol | 1.0 | 1.0 | 1.0 | 1.0 |
| 乙/mol | 1.0 | 2.0 | 1.0 | 1.0 |
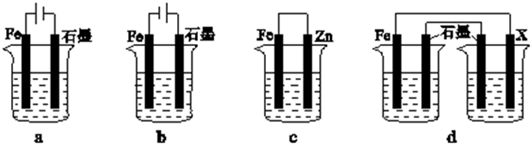
查看答案和解析>>
科目: 来源: 题型:实验题
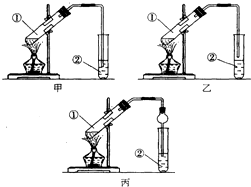 下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.
下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.查看答案和解析>>
科目: 来源: 题型:实验题
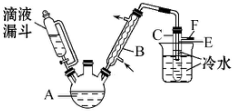 某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:
某校研究性学习小组,用乙醇与浓硫酸和溴化钠反应来制备溴乙烷,装置如下,反应需要加热,图中省去了加热装置,有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在常温下氮气比氧气和氯气稳定 | |
| B. | 氮、氧和氯的单质常温下为气体 | |
| C. | 氮、氧和氯分子在反应过程中释放能量 | |
| D. | 氮气、氧气和氯气的密度不同 |
查看答案和解析>>
科目: 来源: 题型:选择题
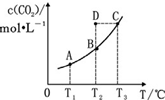 在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度 c(CO2)与温度 T 的关系如图所示.下列说法错误的是( )
在恒容密闭容器中存在下列平衡:CO(g)+H2O(g)?CO2(g)+H2(g).CO2(g)的平衡物质的量浓度 c(CO2)与温度 T 的关系如图所示.下列说法错误的是( )| A. | 反应 CO(g)+H2O(g)?CO2(g)+H2(g)的△H>0 | |
| B. | 在 T2时,若反应处于状态 D,则有 v 正<v 逆 | |
| C. | 平衡状态 A 与 C 相比,平衡状态 A 的 c(CO)小 | |
| D. | 若 T1、T2时的平衡常数分别为 K1、K2,则 K1<K2 |
查看答案和解析>>
科目: 来源: 题型:解答题
 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.某兴趣小组用无水乙醇和冰醋酸制备乙酸乙酯,相关物质的数据如下:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.某兴趣小组用无水乙醇和冰醋酸制备乙酸乙酯,相关物质的数据如下:| 物质 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 分子量 | 46 | 60 | 88 |
| 沸点(℃) | 78.5 | 117.9 | 77.1 |
| 密度(g/cm3) | 0.789 | 1.05 | 0.90 |
查看答案和解析>>
科目: 来源: 题型:实验题
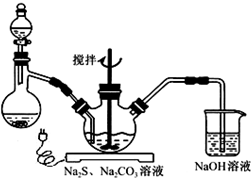 NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题: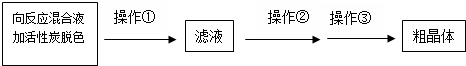
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应,吸热反应的生成物总能量一定高于反应物总能量 | |
| B. | 同温同压下,H2(g)+Cl2(g)═2HCl(g) 在光照和点燃条件下的△H不同 | |
| C. | 一定条件下,0.5 mol N2和1.5 mol H2置于某密闭容器中充分反应生成NH3气,放热19.3kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| D. | 一定条件下4 HCl(g)+O2(g)═2Cl2(g)+2H2O(g),当1 mol O2反应放出115.6 kJ热量,键能如下所示,则断裂1 mol H-O键与断裂1 mol H-Cl键所需能量差为31.9 kJ Cl2(g)$\stackrel{243kJ/mol}{→}$2Cl(g) O2(g)$\stackrel{498kJ/mol}{→}$2O(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com