
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
 盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol KClO3所具有的总能量高于1 mol KCl所具有的总能量 | |
| B. | KClO3分解速率快慢主要取决于反应① | |
| C. | 1 g KClO3,1 g MnO2,0.1 g Mn2O7混合加热,充分反应后MnO2质量为1 g | |
| D. | 将固体二氧化锰碾碎,可加快KClO3的分解速率 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验 编号 | 温度 | 初始pH | 0.1mol/L 草酸溶液/mL | 0.01mol/L KMnO4溶的 体积/mL | 蒸馏水 体积/mL | 待测数据(反应混合液褪色 时间/s) |
| ① | 常温 | 1 | 20 | 50 | 30 | t1 |
| ② | 常温 | 2 | 20 | 50 | 30 | t2 |
| ③ | 常温 | 2 | 40 | a | b | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验结果和结论 |
| 若反应混合液褪色时间小于实验①中的t1,则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
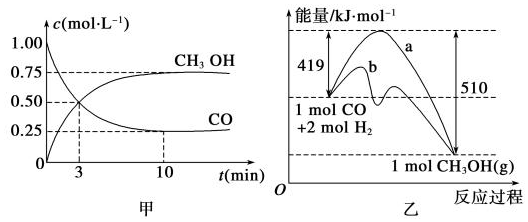
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | △H1<△H3 | B. | △H2>△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2>△H3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 0.5 mol H2SO4与0.5 mol Ba(OH)2完全反应生成BaSO4时放出的热叫做中和热 | |
| C. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 | |
| D. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com