
科目: 来源: 题型:解答题
 新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.
新型纳米材料a-Fe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等.某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰的温度约为500℃.| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 取少量反应后的黑色粉末X,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;产生少量气泡 |
| Ⅱ | 向实验I中得到的溶液滴加2滴KSCN溶液,振荡 | 溶液没有出现红色 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
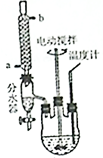 某学习小组以乙二酸(分子式:H2C2O4,结构简式:HOOC-COOH,二元弱酸,俗称草酸)和乙醇为原料制备乙二酸二乙酯,实验步骤如下:
某学习小组以乙二酸(分子式:H2C2O4,结构简式:HOOC-COOH,二元弱酸,俗称草酸)和乙醇为原料制备乙二酸二乙酯,实验步骤如下: .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
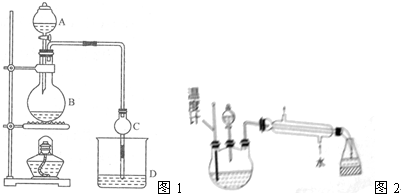
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 是熵减反应 | B. | 是熵增效应大于能量效应 | ||
| C. | 是吸热反应 | D. | 是放热反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=185.57 kJ•mol-1能自发进行,是因为体系有自发地向混乱度增大的方向转变的倾向 | |
| B. | 能自发进行的反应一定能迅速发生 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独做为判断反应能否自发进行的判据 | |
| D. | CaCO3(s)═CaO(s)+CO2(g)△H>0,△S>0,不论在何种条件下都可能自发 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | △H>0、△S<0 | B. | △H>0、△S>0 | C. | △H<0、△S<0 | D. | △H<0、△S>0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 98.32kJ | B. | 196.64kJ/mol | C. | <196.64kJ | D. | >196.64kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 所有△H<0的反应均是自发反应 | |
| B. | 高锰酸钾加热分解是一个熵减小的过程 | |
| C. | 冰在室温下自动熔化成水,是熵增的过程 | |
| D. | 自发进行的反应一定能迅速进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com