
科目: 来源: 题型:解答题
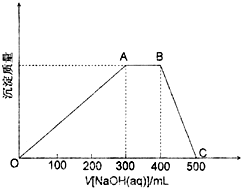
 (1)某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL一定物质的量浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线如图所示.实验过程中需要使用的仪器有铁架台、滴定管夹、酸式滴定管、碱式滴定管、锥形瓶、烧杯,由图可计算出标准HCl溶液的物质的量浓度为2.5mol/L(忽略溶液混合时的体积变化).
(1)某研究性学习小组用一定物质的量浓度的盐酸滴定10.00mL一定物质的量浓度的NaOH溶液,滴定时使用pH计精确测量滴定过程中溶液的pH变化(温度为25℃),并绘制出滴定过程中溶液pH的变化曲线如图所示.实验过程中需要使用的仪器有铁架台、滴定管夹、酸式滴定管、碱式滴定管、锥形瓶、烧杯,由图可计算出标准HCl溶液的物质的量浓度为2.5mol/L(忽略溶液混合时的体积变化).| 实验步骤 | 设计此步骤的目的 |
| 将配制的NaOH溶液加热 | 除去溶液中溶解的氧气 |
| 在加热后的溶液中滴加酚酞,并在上方滴加一些植物油 | 隔绝空气 |
| 实验方案 | 观察到的现象和结论 |
| 分别配制不同浓度的NaOH溶液,然后各滴加2~3滴酚酞溶液,较稀的NaOH溶液中出现红色,很浓的NaOH溶液中无红色出现(或先变红色,一会儿红色消失) | 说明红色消失与NaOH溶液的浓度有关(或:向原红色消失的溶液中慢慢加入足量的水,红色重新出现;说明红色消失与NaOH溶液的浓度有关) |
查看答案和解析>>
科目: 来源: 题型:解答题
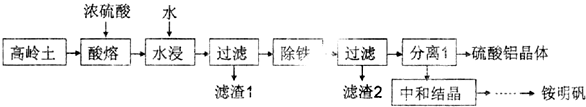
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
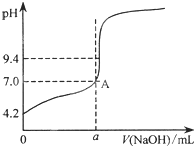 现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:
现用邻苯二甲酸氢钾标准溶液来测定NaOH溶液的浓度.用氢氧化钠溶液来滴定邻苯二甲酸溶液时有下列操作:| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
查看答案和解析>>
科目: 来源: 题型:解答题
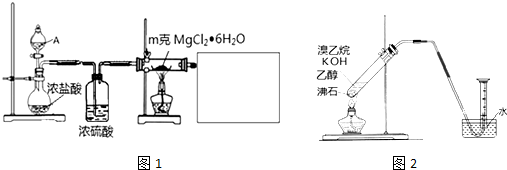
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 滴定 次数 | 待测溶液的体积(mL) | 0.100 0mol•L-1NaOH的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积(mL) | ||
| 第一次 | 20.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 20.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 20.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目: 来源: 题型:解答题
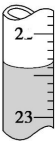 已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:
已知H2C2O4为二元中强酸.某化学兴趣小组为测定含Na2SO4、NaHC2O4和H2C2O4•2H2O的试样中各物质的质量分数,进行了如下实验:查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | Fe3+ | Fe2+ | Cu2+ |
| 开始沉淀 | 1.5 | 6.4 | 4.2 |
| 完全沉淀 | 3.2 | 8.9 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
| C | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | … | 6 |
| 2 | 900 | 6 | 3 | … | 1.5 | 3 |
| 3 | 900 | … | … | … | … | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com