
科目: 来源: 题型:实验题
| 滴定次数 | 标准溶液的体积/mL | 待测盐酸溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 1.05 | 21.10 | 15.00 |
| 2 | 2.00 | 21.95 | 15.00 |
查看答案和解析>>
科目: 来源: 题型:实验题
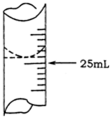 欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:
欲测定某NaOH溶液的物质的量浓度,可用物质的量浓度为0.1000mol•L-1HCl标准溶液进行中和滴定(用酚酞作指示剂).请回答下列问题:| 实验序号 | 待测NaOH溶液的体积/mL | HCl标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 20.10 |
| 2 | 25.00 | 1.50 | 21.40 |
查看答案和解析>>
科目: 来源: 题型:实验题
 在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:
在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用催化剂能加快反应速率,使N2完全转化为NH3 | |
| B. | 当N2、H2、NH3浓度相等时,反应达到化学平衡状态 | |
| C. | 一段时间后,当N2、H2、NH3浓度不再改变时,反应物转化率最大 | |
| D. | 达平衡后,升高温度,反应速率减慢 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 少量的氯水加入到盛有NaBr溶液的试管中 | |
| B. | 取一小片铝,砂纸除去氧化膜,放入试管中,加入少量2mL水 | |
| C. | 将锌片与铜片用导线连接,插入盛稀硫酸的烧杯中 | |
| D. | 向盛有过氧化氢水溶液的试管中,加入少量1mol/LFeCl3溶液 |
查看答案和解析>>
科目: 来源: 题型:实验题
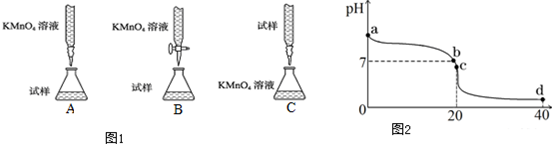
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用滴定管时,滴定管必须用待装液润洗2~3次 | |
| B. | 酸式滴定管不能盛装碱液,碱式滴定管不能盛装酸液 | |
| C. | 盛放准确量取待测液的锥形瓶应预先用待测液润洗 | |
| D. | 滴定操作应重复2至3次,并求出滴定用去的溶液体积的平均值,计算出待测液的浓度 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com