
科目: 来源: 题型:解答题
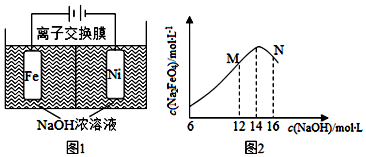
查看答案和解析>>
科目: 来源: 题型:解答题
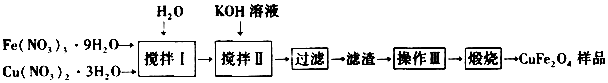
查看答案和解析>>
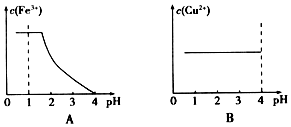
科目: 来源: 题型:实验题
| Fe3+ | Cr3+ | Ni2+ | |
| 开始沉淀pH | 1.5 | 4.3 | 6.9 |
| 完全沉淀pH | 2.8 | 5.6 | 8.9 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度/℃ | 25 | 90℃ | 100℃ |
| 水的离子积常数 | 1×10-14 | 3.8×10-13 | 1×10-12 |
查看答案和解析>>
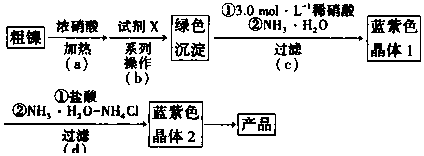
科目: 来源: 题型:实验题
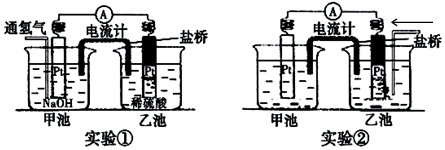
查看答案和解析>>
科目: 来源: 题型:解答题
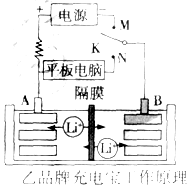 充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来.
充电宝基本都由聚合物锂电池作为储电单元,它本身就是一个聚合物锂电池的储电装置,通过IC芯片进行电压的调控,再通过连接电源线充电或储电后将贮存的电量释放出来.查看答案和解析>>
科目: 来源: 题型:解答题
 已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时铁电极的质量减少11.2g.请回答 下列问题.
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当铅蓄电池中转移0.4mol电子时铁电极的质量减少11.2g.请回答 下列问题.查看答案和解析>>
科目: 来源: 题型:选择题
 人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )
人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图.下列有关说法正确的是( )| A. | A为电源的负极 | |
| B. | 电解结束后,阴极室溶液的pH与电解前相比将不变 | |
| C. | 阳极室中发生的电极反应为2H++2e-═H2↑ | |
| D. | 若两极共收集到气体13.44 L(标准状况),则除去的尿素为18g(忽略气体的溶解) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入少量Na2CO3固体,平衡①右移,平衡②左移,溶液中c(F-)增大 | |
| B. | 加入少量NaOH固体至c(F-)>c(HF),溶液一定呈碱性 | |
| C. | 加入少量Na至pH=8,则C(Na+)-c(F-)=0.99×10-7mol•L-1 | |
| D. | 加入少量盐酸,$\frac{c({F}^{-})}{c(HF)•c(O{H}^{-})}$不变 |
查看答案和解析>>
科目: 来源: 题型:实验题
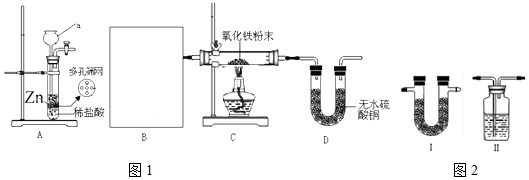
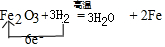 .实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.
.实验结束时应该采取的操作是先停止加热,冷却到室温,再停止通H2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com