
科目: 来源: 题型:选择题
| A. | 标准状况下,a L的氧气和氮气的混合物含有的分子数约为$\frac{a}{22.4}$×6.02×1023 | |
| B. | 由1L 1 mol•L-1的 FeCl3溶液制成的胶体中胶粒总数小于NA个 | |
| C. | 2.3g金属钠变为钠离子失去0.1NA电子 | |
| D. | 2.24L CO2中含有的原子数为3×0.1×6.02×1023 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 10 mL 0.1 mol/L AlCl3溶液 | B. | 20 mL 0.1 mol/L CaCl2溶液 | ||
| C. | 30 mL 0.2 mol/L KCl溶液 | D. | 200 mL 2 mol•L-1KClO3溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可加入硫酸以提高电解质的导电性 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 放电时,Li发生还原反应 | |
| D. | 放电时电池正极反应为:FePO4+e-+Li+═LiFePO4 |
查看答案和解析>>
科目: 来源: 题型:填空题
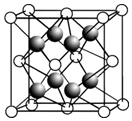 (1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.
(1)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是B.| 电离能/kJ•mol-1 | I1 | I2 |
| 铜 | 746 | 1958 |
| 锌 | 906 | 1733 |
查看答案和解析>>
科目: 来源: 题型:实验题
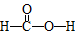 ,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体.甲酸在浓硫酸作用下容易分解产生CO.某化学兴趣小组的同学对HCOOH的性质进行了以下探究: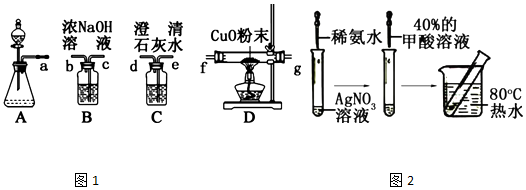
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:解答题
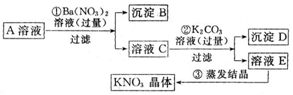
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com