
科目: 来源: 题型:解答题
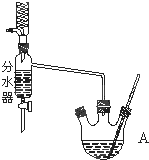 如图为制取乙酸乙酯的实验装置图.回答下列问题:
如图为制取乙酸乙酯的实验装置图.回答下列问题: .
.查看答案和解析>>
科目: 来源: 题型:解答题
 甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=a kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
甲醇是一种可再生的清洁能源,一定条件下用CO和H2合成CH3OH:CO(g)+2H2 (g)?CH3OH(g)△H=a kJ•mol-1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内气体总物质的量随时间(min)的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 将铜粉与硫粉混合均匀加热以制取CuS | |
| B. | 将铜丝插入浓硫酸中并加热,反应后再加水以观察CuSO4溶液的颜色 | |
| C. | 向CuSO4溶液中加入过量的NaOH溶液,过滤洗涤并收集沉淀充分灼烧以制取CuO | |
| D. | 向淀粉溶液中加入适量稀硫酸微热,再加少量新制Cu(OH)2并加热,产生砖红色沉淀 |
查看答案和解析>>
科目: 来源: 题型:解答题
 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度升高,混合气体的颜色变深.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 等体积、等物质的量浓度的氨水与盐酸混合 | |
| B. | 常温下,pH=8的氨水与pH=6的硝酸等体积混合 | |
| C. | 常温下,pH=12的Ba(OH)2溶液与pH=2的NaHSO4溶液等体积混合 | |
| D. | c(H+)=c(OH-)=10-6 mol•L-1的溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钙元素 | B. | 碘元素 | C. | 铁元素 | D. | 钠元素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2KMnO4+H2O2+3H2SO4═K2SO4+2MnSO4+3O2↑+4H2O | |
| B. | 2KMnO4+3H2O2+3H2SO4═K2SO4+2MnSO4+4O2↑+6H2O | |
| C. | 2KMnO4+5H2O2+3H2SO4═K2SO4+2MnSO4+5O2↑+8H2O | |
| D. | 8KMnO4+2H2O2+12H2SO4═4K2SO4+8MnSO4+11O2↑+14H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 无色透明的溶液中:Na+、SO42-、MnO4-、NO3- | |
| B. | 使无色酚酞试液呈红色的溶液中:Na+、Cu2+、SO42-、Cl- | |
| C. | pH=1的溶液中:K+、ClO-、S2-、Cl- | |
| D. | 弱碱性的溶液中:Na+、K+、HCO3-、NO3- |
查看答案和解析>>
科目: 来源: 题型:实验题
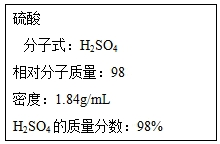 根据要求回答下列问题:
根据要求回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com