
科目: 来源: 题型:解答题
| 滴定次数 | 待测液体积 (mL) | 标准KMnO4溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 25.00 | 0.50 | 20.40 |
| 第二次 | 25.00 | 3.00 | 23.00 |
| 第三次 | 25.00 | 4.00 | 24.10 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 此沉淀是Mg(OH)2、Ca(OH)2的混合物 | |
| B. | 此沉淀只有Mg(OH)2 | |
| C. | 过滤后滤液中存在Ca2+、Mg2+ | |
| D. | 向原溶液中加入8.8 g NaOH固体,不可以使Ca2+部分转化为沉淀 |
查看答案和解析>>
科目: 来源: 题型:解答题
 NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).
NaH2PO4、Na2HPO4可用于合成化工原料三聚磷酸钠(Na5P3O10).| 滴定次数 | 待测溶液A的体积(/mL) | 0.1000mol•L-1NaOH溶液的体积 | |
| 滴定前读数(/mL) | 滴定后读数(/mL) | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目: 来源: 题型:填空题

| 温度 实验次数 | 起始温度t1/℃ | 终止温 度t2/℃ | 平均温度差 (t2-t1)/℃ | ||
| H2SO4溶液 | NaOH溶液 | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4 |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 25℃时,FeS,ZnS、CuS的溶解度依次增大 | |
| B. | ZnS饱和溶液中加入少量NazS固体,平衡后溶液中c(Zn2+)•c(S2-)=Ksp(ZnS),c(Zn2+)=c(S2-) | |
| C. | 除去工业废水中的Cu2+,可用FeS作为沉淀剂 | |
| D. | 某溶液中含有Fe2+、Cu2+和Znz+,浓度均为0.010 moI•L-1.向该溶液中逐滴加入0.010 mol•L-1的Na2S溶液时,Fe2+最先沉淀出来 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 步骤①中加酸,将溶液的pH 调节至2,溶液显黄色,CrO42-离子浓度增大 | |
| B. | 步骤①中当溶液呈现深黄色,且2v(CrO${\;}_{4}^{2-}$)=v(Cr2O72-)时,说明反应2CrO42-(黄色)+2H+?Cr2O72-(橙色)+H2O 达到平衡状态 | |
| C. | 步骤②中,若要还原1 mol Cr2O${\;}_{7}^{2-}$离子,需要6 mol(NH4)2Fe(SO4)2•6H2O | |
| D. | 步骤③中,当将溶液的pH 调节至4 时,可认为废水中的铬元素已基本除尽 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | A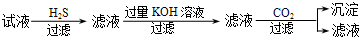 | |
| B. | B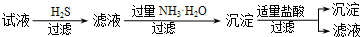 | |
| C. | C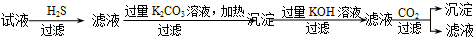 | |
| D. | D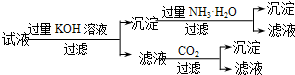 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向AgI中加一定浓度、一定体积的NaCl溶液,AgI可转化为AgCl | |
| B. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度应该大于$\frac{1}{\sqrt{1.8}}$×10-11mol/L | |
| C. | AgI比AgCl更难溶于水,AgCl可以转化为AgI | |
| D. | 向c(Ag+)=1.8×10-4mol/L的溶液中加入等体积NaCl溶液,开始出现AgCl沉淀,则NaCl溶液浓度应大于1.0×10-6mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题
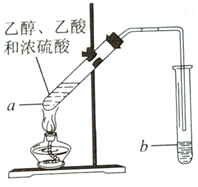 红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了香味的酯.在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.
红葡萄酒密封储存时间越长,质量越好,原因之一是储存过程中生成了香味的酯.在实验室可以用如图所示的装置制取乙酸乙酯,请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com