
科目: 来源: 题型:解答题
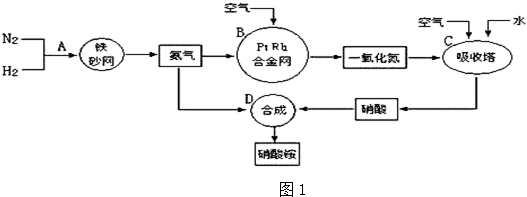
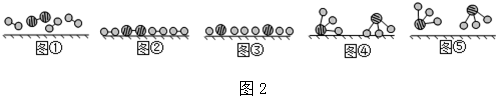
 分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.
分别表示N2、H2、NH3.图⑤表示生成的NH3离开催化剂表面,图②和③的含义分别是N2、H2被吸附在催化剂表面、在催化剂表面,N2、H2中化学键断裂.查看答案和解析>>
科目: 来源: 题型:实验题

| 名称 | 性状 | 密度 | 溶点℃ | 沸点℃ | 溶解度 | |
| 水 | 乙醚 | |||||
| 环已醇 | 无色,有刺激性气味 | 0.9624 | 25.93 | 161.5 | 5.67g/100mL | ∞ |
| 环已酮 | 无色,有刺激性气味 | 0.9478 | - | 155.7 | 2.4g/100mL | ∞ |
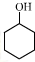 +1 Na2Cr2O7+4H2SO4→3
+1 Na2Cr2O7+4H2SO4→3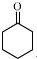 +1 Na2SO4+1 Cr2(SO4)3+7 H2O
+1 Na2SO4+1 Cr2(SO4)3+7 H2O查看答案和解析>>
科目: 来源: 题型:实验题
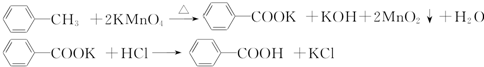
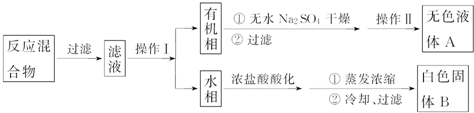
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解,冷却结晶,过滤 | 得到白色晶体和无色滤液 | |
| ② | 取少量滤液于试管中,滴入稀HNO3酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,取适量加热,测定熔点 | 白色晶体在122.4℃熔化为液体 | 白色晶体是苯甲酸 |
查看答案和解析>>
科目: 来源: 题型:实验题
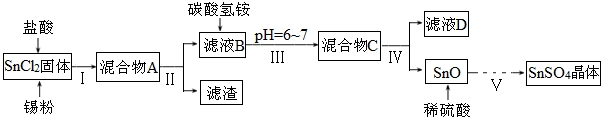
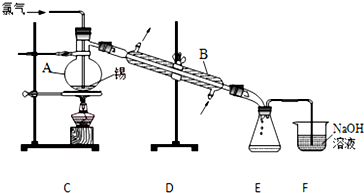
查看答案和解析>>
科目: 来源: 题型:推断题
| H2C2O4 | 无色晶体 | K1=5.9×10-2,K2=6.4×10-5,能溶于水和乙醇 |
| Na2C2O4 | 白色晶体 | 微溶于水,pH=7.2,不溶于乙醇 |
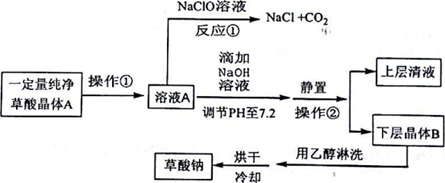
查看答案和解析>>
科目: 来源: 题型:解答题
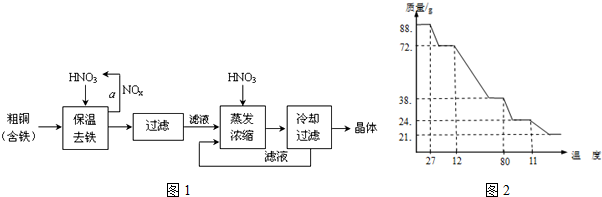
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 1.9 | 3.2 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
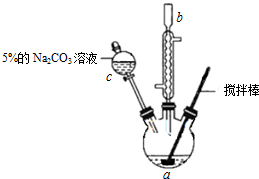
 实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的物理性质见附表).
实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见图,相关物质的物理性质见附表).| 相对分 子质量 | 密度 /(g•cm-3) | 沸点/℃ | |
| 溴 | 160 | 3.119 | 58.8 |
| 苯甲醛 | 106 | 1.04 | 179 |
| 1,2-二氯乙烷 | 99 | 1.2351 | 83.5 |
| 间溴苯甲醛 | 185 | 1.587 | 229 |
查看答案和解析>>
科目: 来源: 题型:解答题
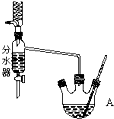 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如表:
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如表:| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度g/l00g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 密度 | 沸点 | 溶解性 | ||
| 丙烯酸 | 1.05g/cm3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
| 甲醇 | 0.79g/cm3 | 64.7℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
| 丙烯酸甲酯 | 0.95g/cm3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
查看答案和解析>>
科目: 来源: 题型:解答题
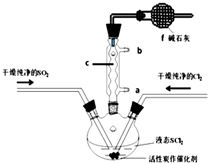 SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:
SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 |  | 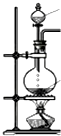 | 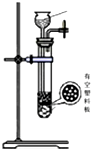 |  |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO | 70%H2SO4+K2SO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com