
科目: 来源: 题型:解答题

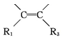 $→_{(2)Zn/H_{2}O}^{(1)O_{2}}$R1CHO+
$→_{(2)Zn/H_{2}O}^{(1)O_{2}}$R1CHO+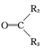
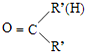 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$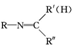 +H2O
+H2O  +HNO3$→_{△}^{浓硫酸}$
+HNO3$→_{△}^{浓硫酸}$ +H2O
+H2O .
.  (写出其中一种的结构简式).
(写出其中一种的结构简式).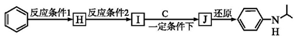 ,
, .
.查看答案和解析>>
科目: 来源: 题型:解答题
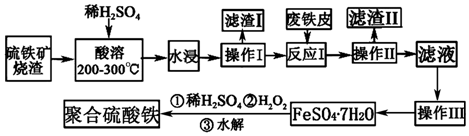
查看答案和解析>>
科目: 来源: 题型:解答题
 甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.
甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示.查看答案和解析>>
科目: 来源: 题型:选择题
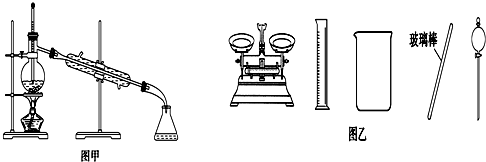
| A. | 闻未知液体气味时,应该将试剂瓶口距离口鼻远一些,用手轻轻扇动 | |
| B. | 将碘单质从碘的CCl4溶液中分离出来可用如图甲所示实验装置 | |
| C. | 用容量瓶配制好一定浓度的某溶液后,塞紧瓶塞并在容量瓶上贴上标签 | |
| D. | 配制500 mL 0.4 mol•L-1NaCl溶液,必要的仪器如图乙所示 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯、氯乙烯、丙烯分子中所有原子均在同一平面 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 2-甲基丁烷也称异丁烷 | |
| D. | 乙醇、甲苯和溴苯可用水鉴别 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 时间 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | c(CH3OH)/mol•L-1 |
| 起始 | 1 | 3 | 0 |
| 第2min | 0.8 | 2.6 | 0.2 |
| 第4min | 0.4 | 1.8 | 0.6 |
| 第6min | 0.4 | 1.8 | 0.6 |
| A. | 第4 min至第6 min该化学反应处于平衡状态 | |
| B. | 第2 min时,如果只改变某一条件,则改变的条件可能加入了H2 | |
| C. | 第2 min时,如果只改变某一条件,则改变的条件可能是使用催化剂 | |
| D. | 第6 min时,其他条件不变,如果升高温度,正反应速率增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在该条件下,反应前后的压强之比为6:5.3 | |
| B. | 若反应开始时容器体积为2 L,则0~2 min内v(SO3)=0.35 mol/(L•min) | |
| C. | 在该条件下充入He气,各物质的反应速率都将增大 | |
| D. | 若反应改为“恒温恒容下”进行,放出Q kJ热量需要的时间将大于2 min |
查看答案和解析>>
科目: 来源: 题型:解答题
 某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.
某科研小组欲研究在其他条件不变的情况下,改变起始氧气的物质的量对合成新型硝化剂反应 4NO2(g)+O2(g)?2N2O5(g)△H<0的影响.查看答案和解析>>
科目: 来源: 题型:解答题
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 390 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 390 | |||
| Ⅲ | 230 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com