
科目: 来源: 题型:选择题
| A. | NH3$→_{催化剂,△}^{O_{2}}$NO$\stackrel{NaOH(aq)}{→}$NaNO2 | |
| B. | Fe2O3$→_{高温}^{Al}$Fe$→_{点燃}^{Cl_{2}}$FeCl3 | |
| C. | SiO2$→_{△}^{H_{2}O}$H2SiO3(aq)$\stackrel{NaOH(aq)}{→}$Na2SiO3 | |
| D. | CuCl2(aq)$\stackrel{NaOH(aq)}{→}$Cu(OH)2$→_{△}^{蔗糖(aq)}$Cu2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Cl2通入水中:Cl2+H2O=2H++Cl-+ClO- | |
| B. | 铜丝插入稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O | |
| C. | 向NaClO溶液中通入过量SO2:ClO-+SO2+H2O=HClO+HSO3- | |
| D. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 28g乙烯与丙烯的混合气体中含有双键数目为NA | |
| B. | 标准状况下,22.4L甘油中含有羟基的数目为3NA | |
| C. | 1L0.1mol•L-1NaHS溶液中,HS-与S2-数目之和为0.1 NA | |
| D. | 0.2molCl2与0.1molCH4充分反应,生成HCl分子数为0.2 NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 臭氧具有氧化性,可用作自来水的消毒剂 | |
| B. | 活性炭具有还原性,可用作制糖业脱色剂 | |
| C. | 氢氟酸具有弱酸性,可用作玻璃的蚀刻剂 | |
| D. | 氨气具有弱碱性,可用作食品工业制冷剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 58.5 g氯化钠固体中含有NA个氯化钠分子. | |
| B. | 1 mol Fe参与反应失去电子数目一定为2NA | |
| C. | 1 molNA被完全氧化生成Na2O2,失去2NA个电子 | |
| D. | 常温下,46 g NO2和N2O4的混合物中含有的氮原子数为NA |
查看答案和解析>>
科目: 来源: 题型:解答题
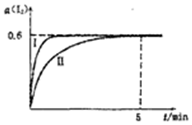 将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)?2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示
将1.0mol I2 (g)和2.4mcl H2置于某2L密闭容器中,在某一温度下发生反应H2(g)+I2(g)?2HI(g)△H<0,并达平衡,12的转化率a(I2)随时间变化如图曲线Ⅱ所示查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
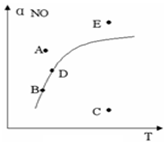 在其它条件一定时,图中曲线表示反应2NO(g)+O2(g)?2NO2(g)△H>0达平衡时NO 的转化率与温度的关系,图上标有A、B、C、D、E点,下列有关说法正确的是( )
在其它条件一定时,图中曲线表示反应2NO(g)+O2(g)?2NO2(g)△H>0达平衡时NO 的转化率与温度的关系,图上标有A、B、C、D、E点,下列有关说法正确的是( )| A. | A点反应未达到平衡状态,且反应正向移动 | |
| B. | C点NO转化率最低,且化学反应速率最小 | |
| C. | B、D两点均处于相应温度下的化学平衡状态,且αB(NO)<αD(NO) | |
| D. | E点反应未达平衡,反应正向移动,容器类压强增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1mol/L Na2CO3溶液中的Na+ 数目为2NA | |
| B. | 标准状况下,11.2L CCl4所含分子数为0.5NA | |
| C. | 各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.2NA | |
| D. | 1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com