
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
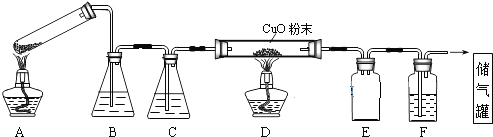
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3COOH(aq)+NaOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.3kJ/mol | |
| B. | KOH(aq)+$\frac{1}{2}$H2SO4(aq)=$\frac{1}{2}$K2SO4(aq)+H2O(l)△H=+57.3kJ/mol | |
| C. | C8H18(l)+$\frac{25}{2}$ O2 (g)=8CO2 (g)+9H2O(g)△H=-5518kJ/mol | |
| D. | 2C8H18(g)+25O2 (g)=16CO2 (g)+18H2O(1)△H=-11036kJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题
 在恒温恒容的密闭容器中,通入lmolN2和3molH2,发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g).
在恒温恒容的密闭容器中,通入lmolN2和3molH2,发生反应:N2(g)+3H2(g)$?_{催化剂}^{高温高压}$ 2NH3(g).查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.9kJ/mol | B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-241.8kJ/mol | ||
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=+285.9kJ/mol | D. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+241.8kJ/mol |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、Cl- | D. | NH4+、K+、Cl-、NO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
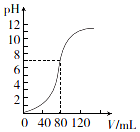 用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )
用1.0mol•L-l NaOH溶液中和某浓度H2SO4溶液时,其pH和所加NaOH溶液的体积(V)关系如图所示.则原硫酸溶液的物质的量浓度和恰好中和时溶液的总体积分别是(假设混合后溶液总体积为二者体积之和)( )| A. | 0.5 mol•L-1、160 mL | B. | 1.0 mol•L-1、160 mL | ||
| C. | 0.5 mol•L-1、80 ml | D. | 1.0 mol•L-1、80 ml |
查看答案和解析>>
科目: 来源: 题型:选择题
| HCN | HF | CH3COOH | HNO2 | |
| Ka | 6.2×10-10 | 6.8×10-4 | 1.8×10-5 | 6.4×10-6 |
| A. | HCN | B. | CHSCOOH | C. | HF | D. | HNOp |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com