
科目: 来源: 题型:实验题
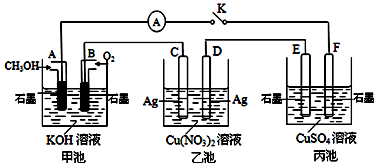
查看答案和解析>>
科目: 来源: 题型:实验题
 如图是用自来水制备蒸馏水的实验装置图.
如图是用自来水制备蒸馏水的实验装置图.查看答案和解析>>
科目: 来源: 题型:实验题
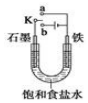 某课外活动小组同学用如图装置进行实验,试回答下列问题
某课外活动小组同学用如图装置进行实验,试回答下列问题查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
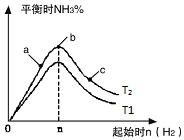 在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.
在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)?2NH3(g)△H2=-92.4kJ/mol,有关数据及特定平衡状态见表.| 容器 | 起始投入 | 达平衡时 | |||
| 甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
| 乙 | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 | |
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入氨气的物质的量 |
| y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时氨气的转化率 |
查看答案和解析>>
科目: 来源: 题型:实验题
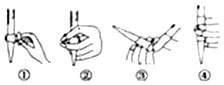
查看答案和解析>>
科目: 来源: 题型:解答题
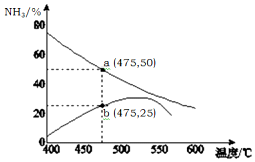 氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料.工业合成氨的反应如下:N2(g)+3H2(g)$?_{高温高压}^{催化剂}$ 2NH3(g)△H=-92.4kJ•mol-1 $→_{键断裂}^{498J/mol}$
$→_{键断裂}^{498J/mol}$ +
+
 $→_{键断裂}^{946kJ/mol}$
$→_{键断裂}^{946kJ/mol}$ +
+
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com