
科目: 来源: 题型:选择题
| A. | ④⑤⑥ | B. | ①②③④ | C. | ①②④⑥ | D. | ②③④ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 30% | B. | 40% | C. | 50% | D. | 60% |
查看答案和解析>>
科目: 来源: 题型:解答题
| 化学反应及平衡常数 | 平衡常数数值 | ||
| 500℃ | 800℃ | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | 2.5 | 0.375 |
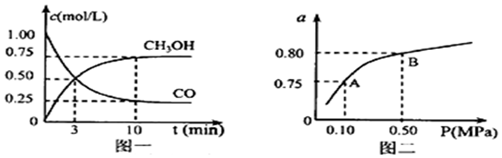
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.40mol | B. | 小于0.20mol | ||
| C. | 大于0.20mol | D. | 小于0.40mol,大于0.20mol |
查看答案和解析>>
科目: 来源: 题型:实验题
| 实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 |
| 1 | 400 | p | 3.0 | 7.0 |
| 2 | t | 101 | 3.0 | 7.0 |
| 3 | 400 | 101 | 3.0 | 7.0 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol | B. | 0.5 mol | C. | 0.75 mol | D. | 0.25 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.2mol H2和4.48L HCl气体 | B. | 标准状况下1mol O2和22.4L H2O | ||
| C. | 2g 氦气和标准状况下11.2L CO2 | D. | 4L CO和4L CO2 |
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 蛋白质在体内代谢的最终产物是硝酸 | |
| B. | 灼烧蛋白质没有明显现象 | |
| C. | 误食重金属盐会使人中毒,应立即喝牛奶、豆浆解毒 | |
| D. | 加热会使蛋白质变性,因此生吃鸡蛋比熟吃好 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2体积SO2和足量O2反应,一定不能生成2体积SO3 | |
| B. | 其他条件不变,增大压强,正反应速率增大逆反应速率也增大 | |
| C. | 加入2molSO2和1molO2放出的热量是加入1molSO2和0.5molO2放出热量的2倍 | |
| D. | 平衡后再加入1molSO3,SO2的转化率增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com