
科目: 来源: 题型:解答题
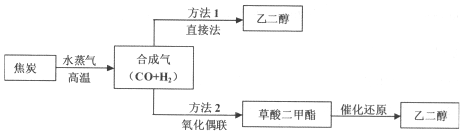
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验编号 | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.10mL | 18.40mL |
| 第二次 | 3.00mL | 21.10mL |
| 第三次 | 0.20mL | 20.40mL |
| 第四次 | 0.00mL | 18.20mL |
查看答案和解析>>
科目: 来源: 题型:实验题
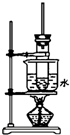 如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).
如图是实验室制取酚醛树脂的装置图(烧杯底部垫有石棉网).查看答案和解析>>
科目: 来源: 题型:解答题
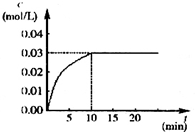 在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:
在某一容积为5L的密闭容器内,加入 0.2mol的CO和0.2mol的H2O,在催化剂存在和800℃的条件下加热,发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g);△H>0反应中CO2的浓度随时间变化情况如下图:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
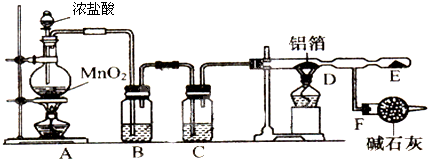
查看答案和解析>>
科目: 来源: 题型:解答题
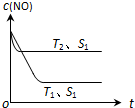 汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染.
汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务.在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物进行相互反应,生成无毒物质;或者使用新型燃料电池作汽车动力,减少汽车尾气污染.
| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c (NO)(×10-3 mol•L-1) | 1.00 | 0.50 | 0.20 | 0.10 | 0.10 |
| c (CO)(×10-3 mol•L-1) | 3.00 | 2.50 | 2.20 | 2.10 | 2.10 |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
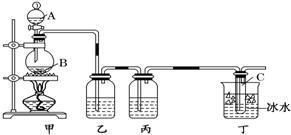
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com