
科目: 来源: 题型:选择题
| A. | 10g H2 | B. | 2molCl2 | C. | 1.5NACO2 | D. | 22.4LO2(标准状况) |
查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:选择题
| 温度( oC) | 15.0 | 25.0 | 30.0 | 35.0 |
| K/(×10-8 mol3•L-3) | 0.205 | 1.64 | 4.68 | 10.8 |
| A. | 若Z的体积分数不再随时间变化时表示反应达平衡状态 | |
| B. | 35 oC时,达平衡时,X分解了 0.03 mol | |
| C. | 该反应在高温下可能自发 | |
| D. | 若在恒温下,压缩容器体积,再次达平衡后,n(X)比原平衡大 |
查看答案和解析>>
科目: 来源: 题型:推断题
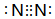 .
. NH3•H2O
NH3•H2O  NH4++OH-.
NH4++OH-.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
查看答案和解析>>
科目: 来源: 题型:解答题
| U | |||
| W | Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com