
科目: 来源: 题型:实验题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
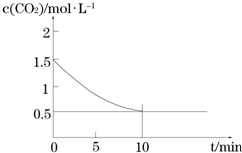
查看答案和解析>>
科目: 来源: 题型:实验题
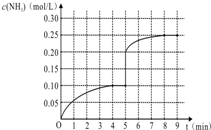 在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:
在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图:查看答案和解析>>
科目: 来源: 题型:选择题
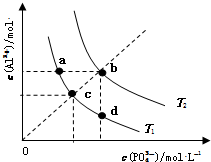
| A. | 图象中四个点的Ksp:a=b>c>d | B. | AlPO4在b点对应的溶解度大于c点 | ||
| C. | AlPO4(s)→Al3+(aq)+PO43-(aq)△H<0 | D. | 升高温度可使d点移动到b点 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 两清液混合,AgCl和AgI都沉淀 | |
| B. | 向AgI清液加入AgNO3,c(Ag+)增大,KSp(AgI)也增大 | |
| C. | 若取0.1435克AgCl固体放入100mL水(忽略体积变化),c(Cl-)为0.01mol/L | |
| D. | 若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 图象中四个点的Ksp:a=b>c>d | B. | AlPO4在b点对应的溶解度大于c点 | ||
| C. | AlPO4(s)?Al3+(aq)+PO43-(aq)△H<0 | D. | 升高温度可使d点移动到b点 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | MnS的Ksp比CuS的Ksp小 | |
| B. | 该反应达平衡时c(Mn2+)=c(Cu2+) | |
| C. | 设该反应的平衡常数为K,则该关系成立:K×Ksp(CuS)=Ksp(MnS) | |
| D. | 往平衡体系中加入少量CuSO4固体后,c(Cu2+)减小,c(Mn2+)变大 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AgCl不能转化为AgI | |
| B. | 25℃时,0.1mol/L HF溶液pH=l | |
| C. | 25℃时,使AgCl转化为AgI,则加入KI溶液的浓度不低于5×10-12mol/L | |
| D. | 向1L0.1mol/LHF溶液中加入1L 0.1mol/LCaCl2溶液,没有沉淀产生 |
查看答案和解析>>
科目: 来源: 题型:解答题
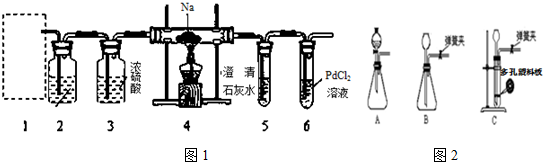
查看答案和解析>>
科目: 来源: 题型:选择题
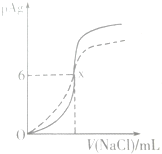 已知pAg=-lg(Ag+),Ksp(AgCl)=1×10-12.如图是向10ml AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )
已知pAg=-lg(Ag+),Ksp(AgCl)=1×10-12.如图是向10ml AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图象(实线).根据图象所得下列结论正确的是[提示:Ksp(AgCl)>Ksp(AgI)]( )| A. | 相同温度下,AgCl在纯水和在NaCl溶液中的溶解度相等 | |
| B. | 原AgNO3溶液的物质的量浓度为0.1mol/L | |
| C. | 图中x的坐标为(100,6) | |
| D. | 0.1mol/L的NaCl溶液换成0.1mol/L的NaI溶液时,图象变为虚线部分 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com