
科目: 来源: 题型:填空题
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
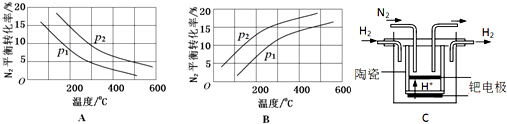
查看答案和解析>>
科目: 来源: 题型:解答题
 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| t2~t3 | t4~t5 | t5~t6 |
| K1 | K2 | K3 |
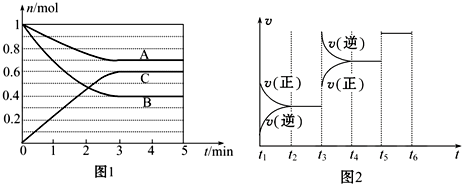
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Ksp只与难溶电解质的性质和温度有关 | |
| B. | 由于Ksp(ZnS)>Ksp(CuS),所以ZnS沉淀在一定条件下可转化为CuS沉淀 | |
| C. | 难溶电解质Mg(OH)2的Ksp=c( Mg2+)•c(OH-) | |
| D. | 25℃,Ksp(AgCl)=1.8×10-10,则AgCl饱和水溶液体系中c(Ag+)为$\sqrt{1.8}$×10-5mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题
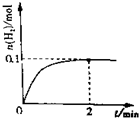 空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO2、NOx等进行研究具有重要意义.请回答下列问题:
空气中的污染物主要来源为燃煤、机动车尾气等.因此,CO、SO2、NOx等进行研究具有重要意义.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
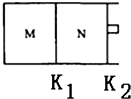 恒温下,向一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
恒温下,向一个4L的密闭容器中充入5.2molH2和2molN2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目: 来源: 题型:填空题
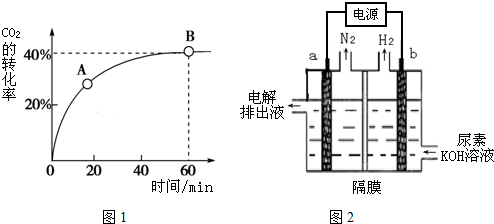
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com