
科目: 来源: 题型:解答题
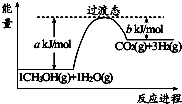
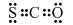 ;生成CO(g)与Sx(s)反应的热化学方程式是xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol
;生成CO(g)与Sx(s)反应的热化学方程式是xCOS(g)=xCO(g)+Sx(s)△H=0.5x(b-a)kJ/mol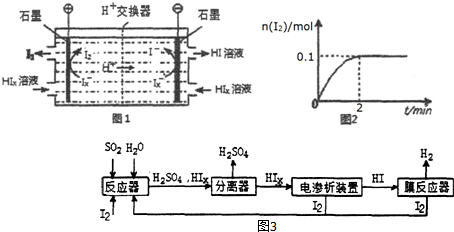
查看答案和解析>>
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
| 时间/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:实验题
 “洁净煤技术”研究在世界上相当普遍.
“洁净煤技术”研究在世界上相当普遍.查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
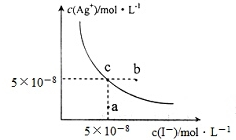
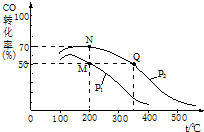
| A. | 在t℃时,Agl的Ksp=2.5×10-15 | |
| B. | 图中b点有碘化银晶体析出 | |
| C. | 向c点溶液中加入适量蒸馏水,可使溶液由c点到a点 | |
| D. | 在t℃时,反应AgBr(s)+I-(aq)?Agl(s)+Br-(aq)的平衡常数K=200 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | FeS的Ksp小于CuS的Ksp | |
| B. | 达到平衡时c(Fe2+)=c(Cu2+) | |
| C. | 溶液中加入少量 Na2S固体后,溶液中c (Cu2+)、c (Fe2+)都减小 | |
| D. | 该反应平衡常数 K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(CuS)}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com