
科目: 来源: 题型:选择题
| A. | 乙烯分子中C═C双键中有一个键容易断裂 | |
| B. | 乙烯分子中6个原子共平面 | |
| C. | 不能用酸性高锰酸钾溶液除去乙烷中混有的乙烯 | |
| D. | 乙烷和乙烯都能使溴水褪色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 简单气态氢化物沸点Y>X>W | |
| B. | 原子半径Z>Y>X>W | |
| C. | Y元素可能位于第二周期第ⅦA族 | |
| D. | Y元素与其它三种元素均可形成多种化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
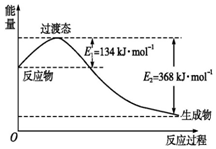 写出下列反应的热化学方程式
写出下列反应的热化学方程式查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该试剂的物质的量浓度为9.2 mol•L-1 | |
| B. | 该硫酸50 mL与足量的铜反应可得到标准状况下SO2 10.3 L | |
| C. | 硫酸是强电解质 | |
| D. | 该硫酸与等体积的水混合所得溶液的质量分数小于49% |
查看答案和解析>>
科目: 来源: 题型:解答题
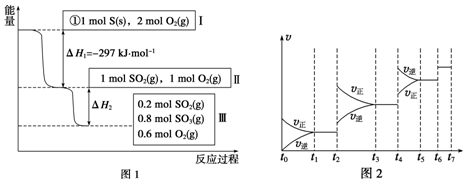
| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2CO3 | B. | NaOH | C. | Mg(OH)2 | D. | NH3•H2O |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 增加C,B的平衡转化率不变 | |
| B. | 此时,B的平衡转化率是35% | |
| C. | 增大该体系的压强,平衡向右移动,化学平衡常数增大 | |
| D. | 该反应的化学平衡常数表达式是K=$\frac{{c}^{4}(C){c}^{2}(D)}{{c}^{3}(A){c}^{2}(B)}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com