
科目: 来源: 题型:选择题
| A. | Fe3+ | B. | Cr3+ | C. | Zn2+ | D. | Mg2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
 t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )| A. | 加热蒸发饱和Ag2CrO4溶液再恢复到t℃,可使溶液由Y点变到Z点 | |
| B. | 在X点没有Ag2CrO4沉淀生成,则此时温度低于t℃ | |
| C. | 向饱和Ag2CrO4溶液中加入少量AgNO3固体,可使溶液由Z点到Y点 | |
| D. | 在t℃时,Ag2CrO4的Ksp为1×10-9 |
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:推断题
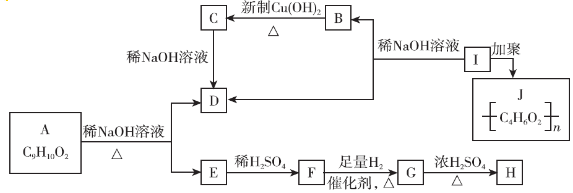
 .
.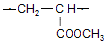 .
.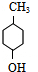 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$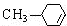 +H2O.
+H2O. .
.查看答案和解析>>
科目: 来源: 题型:实验题
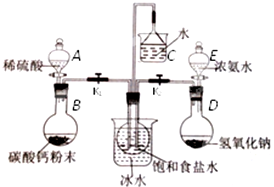
查看答案和解析>>
科目: 来源: 题型:推断题

查看答案和解析>>
科目: 来源: 题型:实验题
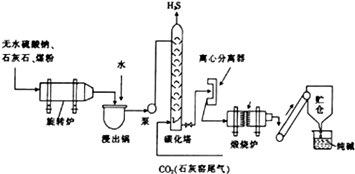 历史上路布兰法生产纯碱的工艺流程如图所示.
历史上路布兰法生产纯碱的工艺流程如图所示.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 当混合气体的质量不变,说明反应已达平衡状态 | |
| B. | 缩小容器体积,重新达到平衡时,气体混合物中C%可能增大 | |
| C. | 在恒压容器中升高温度,气体混合物中C%可能先增大后减小 | |
| D. | 在恒容容器中升高温度,达到新平衡时,气体的密度增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 温度升高,Na2CO3溶液中各种离子的浓度均增大 | |
| B. | 沉淀转化的离子方程式为CO32-(aq)+CaSO4(s)?CaCO3(s)+SO42-(aq) | |
| C. | 该条件下CaCO3的溶解度约为1×10-3g | |
| D. | CaCO3和CaSO4共存的体系中,一定有$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=9×104 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com