
科目: 来源: 题型:选择题
| A. | N2(g)+3H2(g)?2NH3(g),恒容条件下达到平衡后充入He,N2的转化率与时间的关系 | |
| B. | CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0,平衡后CH4的物质的量与△H的关系 | |
| C. | FeCl3+3KSCN?Fe(SCN)3+3KCl,平衡后加入KCl固体,c(Cl-)与正反应速率关系 | |
| D. | H2(g)+I2(g)?2HI(g),平衡后缩小容器容积,速率与时间的关系 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.45 倍,则m+n>p+q | |
| B. | 若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n | |
| C. | 若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△H<0 | |
| D. | 若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
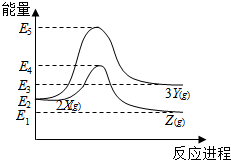
| A. | 由X→Y反应的△H=E5-E2 | B. | 由X→Z反应的△H>0 | ||
| C. | 降低压强有利于提高Y的产率 | D. | 升高温度有利于提高Z的产率 |
查看答案和解析>>
科目: 来源: 题型:解答题
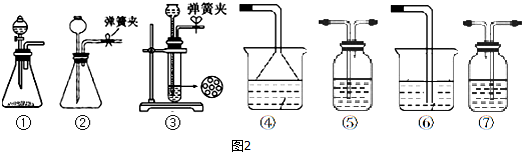
查看答案和解析>>
科目: 来源: 题型:解答题
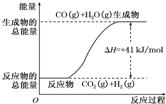 (1)已知14g N2与足量H2反应放出46kJ的热量,则该反应的热化学方程式是N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol
(1)已知14g N2与足量H2反应放出46kJ的热量,则该反应的热化学方程式是N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ/mol →
→
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向5mL 0.4mol•L-1 NaOH溶液中先加入3滴1mol•L-1MgCl2溶液,再加入3滴1mol•L-1FeCl3溶液,能证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | |
| B. | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成,说明淀粉没有水解成葡萄糖 | |
| C. | 用某已知浓度的HCl 滴定未知浓度的NaOH,滴定前尖嘴有气泡滴定终点气泡消失,则测定所得NaOH的浓度偏低 | |
| D. | 向氯水中滴加AgNO3、稀HNO3溶液,若产生白色沉淀,则说明氯水中含有氯离子 |
查看答案和解析>>
科目: 来源: 题型:推断题
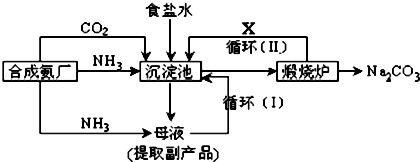
查看答案和解析>>
科目: 来源: 题型:实验题
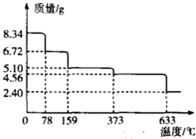 铁及其化合物在工农业生产、科学研究等方面具有广泛用途.回答下列问题:
铁及其化合物在工农业生产、科学研究等方面具有广泛用途.回答下列问题:| 温度/℃ | 500 | 700 | 900 |
| K | 1.00 | x | Y |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com