
科目: 来源: 题型:选择题
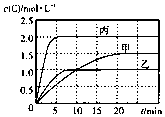 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以表和图表示
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以表和图表示| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5 molB | 1.5 molA 0.5 molB | 6.0 molA 2.0 molB |
| A. | 若平衡时温度不变,改变容器体积平衡不移动 | |
| B. | 由图可知:T1<T2,且该反应为吸热反应 | |
| C. | l0min内甲容器中反应的平均速率v(A)=0.025mol•(L•min)-1 | |
| D. | T1℃,起始时甲容器中充入0.5molA、1.5molB,平衡时A的转化率为25% |
查看答案和解析>>
科目: 来源: 题型:选择题
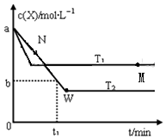 在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )
在恒容密闭容器中通入X并发生反应:2X(g)?Y(g),温度T1、T2下X的物质的量浓度c(x)随时间t变化的曲线如图所示,下列叙述正确的是( )| A. | M点时再加入一定量的X,平衡后X的转化率增大 | |
| B. | T2下,在0~t1时间内,v(Y)=$\frac{a-b}{{t}_{1}}$mol/(L•min) | |
| C. | M点的正反应速率v正小于N点的逆反应速率v逆 | |
| D. | 该反应进行到M点吸收的热量小于进行到W点放出的热量 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.96 | 0.96 |
| N2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
| CO2 | 0 | 0.42 | 0.60 | 0.60 | 0.72 | 0.72 |
查看答案和解析>>
科目: 来源: 题型:选择题
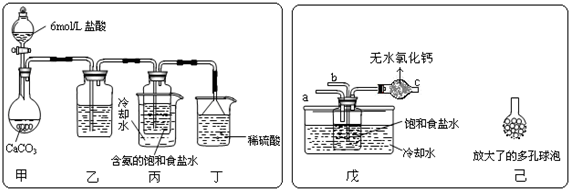
 某同学Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)△H=+13.8kJ/mol
某同学Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)△H=+13.8kJ/mol| A. | 该反应是一个氧化还原反应 | |
| B. | 待试管b中溶液颜色不变的目的是使Cr2O72-完全反应 | |
| C. | 该实验不能证明减小生成物浓度,平衡正向移动 | |
| D. | 试管c中的现象说明影响平衡的主要因素是温度 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | A气体是NH3 | |
| B. | 悬浊液的离子主要有Na+、NH4+、Cl-、HCO3- | |
| C. | 第Ⅲ步操为过滤 | |
| D. | 第Ⅳ步操作所使用的仪器主要有铁架台、酒精灯、蒸发皿、玻璃棒 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
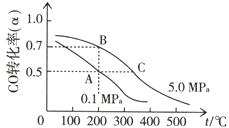 “洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ•m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了热值高达122500~16000kJ•m-3的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.查看答案和解析>>
科目: 来源: 题型:多选题
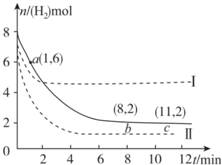
| A. | 若曲线I对应的条件改变是升高温度,则该反应△H>0 | |
| B. | 曲线II对应的条件改变是降低压强 | |
| C. | 反应开始至a点时v(H2)=1mol•L-1•min-1 | |
| D. | 保持温度不变,若将平衡后的容器体积缩小至1L,重新达平衡时则2 mol•L-1<c(CH3OH)<$\frac{8}{3}$mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com