
科目: 来源: 题型:实验题
| 化学键 | C═O(CO2) | C═O(COS) | C═S | H-S | H-O |
| E(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
查看答案和解析>>
科目: 来源: 题型:实验题
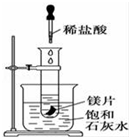 如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:
如图所示,把试管放入盛有25℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10mL盐酸于试管中,试回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
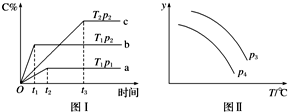 在某容积一定的密闭容器中,可逆反应:A(g)+B(g)═xC(g)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)( )
在某容积一定的密闭容器中,可逆反应:A(g)+B(g)═xC(g)有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,p表示压强,C%表示C的体积分数)( )| A. | p3>p4,y轴表示A的物质的量 | |
| B. | p3<p4,y轴表示B的体积分数 | |
| C. | p3<p4,y轴表示混合气体的密度 | |
| D. | p3>p4,y轴表示混合气体的平均相对分子质量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 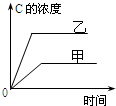 研究的是温度对反应的影响,且乙的温度较高 | |
| B. | 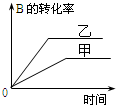 研究的是压强对反应的影响,且甲的压强较高 | |
| C. | 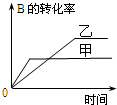 研究的是温度对反应的影响,且乙的温度较高 | |
| D. | 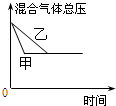 研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较高 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 | 320 |
| CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 65 | 62 |
| CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 58 | 52 |
| A. | 反应①、②均为吸热反应 | |
| B. | 290℃时反应②平衡常数值达到最大 | |
| C. | 平衡时,反应①与②中CH3OH的消耗速率一定相等 | |
| D. | 增大压强能增大CH3OCH3产率 |
查看答案和解析>>
科目: 来源: 题型:解答题
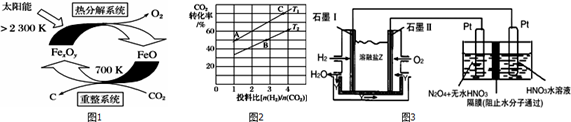
查看答案和解析>>
科目: 来源: 题型:解答题
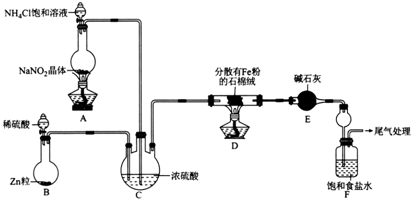
查看答案和解析>>
科目: 来源: 题型:选择题
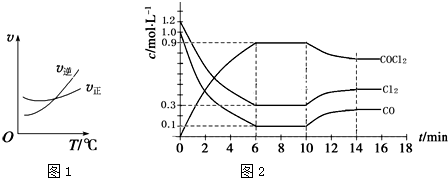
| A. | 0~6 min内,反应的平均速率v(Cl2)=0.15 mol•L-1•min -1 | |
| B. | 若保持温度不变,在第7 min 向体系中加入这三种物质各2 mol,则平衡向正反应方向移动 | |
| C. | 随温度升高,该反应平衡常数减小;比较第8 min反应温度T(8)与第15 min反应温度T(15)的高低:T(8)>T(15) | |
| D. | 若将初始投料浓度变为c(Cl2)=0.7 mol/L、c(CO)=0.5 mol/L、c(COCl2)=0.5 mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6 min时Cl2的体积分数相同 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com