
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:推断题
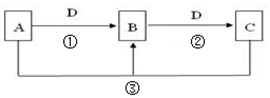 常见无机物A、B、C、D存在如图转化关系:
常见无机物A、B、C、D存在如图转化关系:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2、H2S | B. | NH3、CO2 | C. | Cl2、CO2 | D. | SO2、Cl2 |
查看答案和解析>>
科目: 来源: 题型:选择题
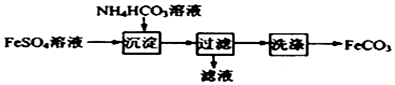
| A. | 产品FeCO3在空气中高温分解可得到纯净的FeO | |
| B. | 可利用KSCN溶液检验FeSO4溶液是否变质 | |
| C. | 沉淀过程中有CO2气体放出 | |
| D. | 检验沉淀是否洗涤干净可用盐酸酸化的BaCl2溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1molKClO4 | B. | 0.1molKClO3 | C. | 0.1molKClO2 | D. | 0.2molKClO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 水玻璃中通入过量二氧化硫:Na2SiO3+SO2+H2O═2Na++SO32-+H2SiO3↓ | |
| B. | 铁屑溶于过量稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| C. | 往碳酸钙中滴加稀盐酸:CO32-+2H+═H2O+CO2↑ | |
| D. | 在NaOH溶液中加入少量Ca(HCO3)2溶液:Ca2++2HCO3-+2OH -═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 焰色反应 | B. | 氧化性 | C. | 还原性 | D. | 不稳定性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | a=4 | |
| B. | S2O32-是还原剂 | |
| C. | 将Y均匀分散到水中形成的体系具有丁达尔效应 | |
| D. | 每有3 mol Fe2+参加反应,反应中转移的电子总数为5 mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,5.6L CCl4含有的分子数为0.25NA | |
| B. | 标准状况下,14 g氮气含有的核外电子数为5NA | |
| C. | 标准状况下,22.4 L任意比的氢气和氯气的混气中含有分子总数均为NA | |
| D. | 在标准状况下,18gH2O所含有的电子数不是10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com