
科目: 来源: 题型:解答题
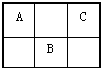 A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示,A、C两元素原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等. 、
、 .
.查看答案和解析>>
科目: 来源: 题型:实验题
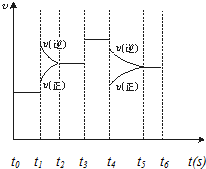 在一密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g)(正反应放热),如图是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:
在一密闭体系中发生下列反应:N2(g)+3H2(g)?2NH3(g)(正反应放热),如图是某一时间段中反应速率与反应进程的曲线关系图,回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
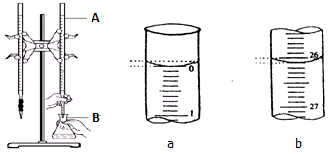
查看答案和解析>>
科目: 来源: 题型:填空题

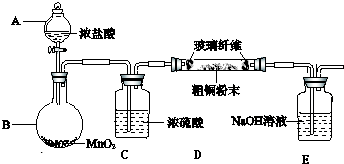
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 已知:Ⅰ:对于反应:H2(g)+Cl2(s)═2HCl (g)△H=-a kJ/mol, Ⅱ:  且a、b、c均大于零,则断开1molH-Cl键所需的能量为-a-b-c | |
| B. | 若2C(s)+O2(g)═2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 如图可表示水分解过程中的能量变化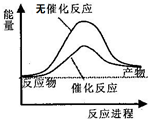 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
| t/min | 1 | 4 | 8 | 11 |
| n(H2)mol | 6 | 2.6 | 2 | 2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | MnS的溶解度小于PbS、CuS、CdS等硫化物的溶解度 | |
| B. | 除杂试剂MnS也可用Na2S替代 | |
| C. | MnS与Cu2+反应的离子方程式是Cu2++S2-=CuS↓ | |
| D. | 整个过程涉及的反应类型有氧化还原反应和复分解反应 |
查看答案和解析>>
科目: 来源: 题型:填空题
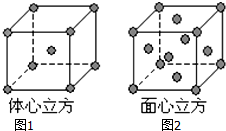 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 气体A的平衡转化率大于气体B的平衡转化率 | |
| B. | 物质D的聚集状态一定是气体 | |
| C. | 平衡后升高温度,若平衡向左移动,则正反应的△H>0 | |
| D. | 平衡后若减小该体系的压强,则平衡向左移动,化学平衡常数增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com