
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
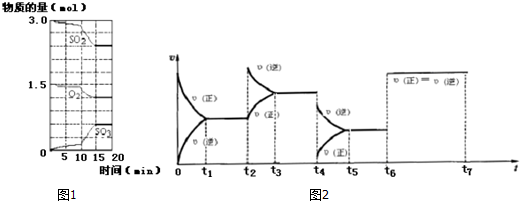
查看答案和解析>>
科目: 来源: 题型:选择题
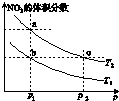 在密闭容器中充入一定量的NO2,发生反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是( )
在密闭容器中充入一定量的NO2,发生反应2NO2(g)?N2O4(g)△H=-57kJ•mol-1.在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示.下列说法正确的是( )| A. | a、c两点的反应速率:a>c | B. | 由a点到b点,可以用加热的方法 | ||
| C. | a、c两点气体的颜色:a深,c浅 | D. | a、b两点NO2的转化率:a<b |
查看答案和解析>>
科目: 来源: 题型:实验题
 碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:查看答案和解析>>
科目: 来源: 题型:实验题
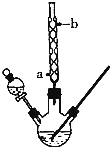 某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去).请回答下列问题:
某化学课外小组设计了如图所示的装置制取乙酸乙酯(图中夹持仪器和加热装置已略去).请回答下列问题:| 乙醇 | 乙酸 | 乙酸乙酯 | 98%浓硫酸 | |
| 熔点/℃ | -117.3 | 16.6 | -83.6 | - |
| 沸点/℃ | 78.5 | 117.9 | 77.5 | 338.0 |
查看答案和解析>>
科目: 来源: 题型:实验题
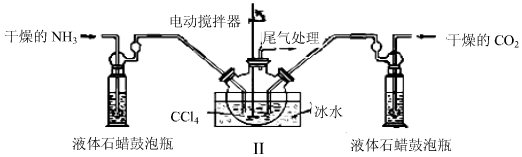
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目: 来源: 题型:解答题
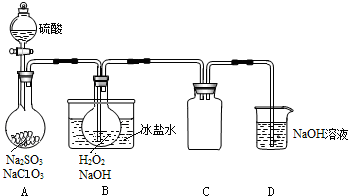
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2)/mol | 0 | 1 | 3 | 1 |
| n(H2)/mol | 0 | 2 | 2 | 1 |
| n(CO)/mol | 3 | 0.5 | 1 | 2 |
| n(H2O)/mol | 3 | 2 | 5 | 2 |
查看答案和解析>>
科目: 来源: 题型:解答题
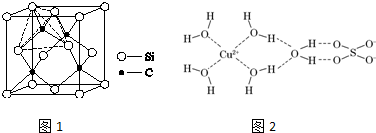
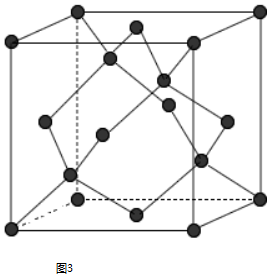
 ;亚铜离子(Cu+)基态时的电子排布式为1s22s22p63s23p63d10或[Ar]3d10.
;亚铜离子(Cu+)基态时的电子排布式为1s22s22p63s23p63d10或[Ar]3d10.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com