
科目: 来源: 题型:实验题
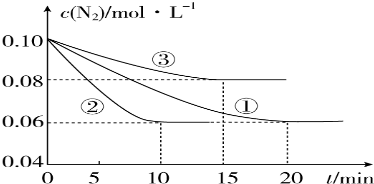
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
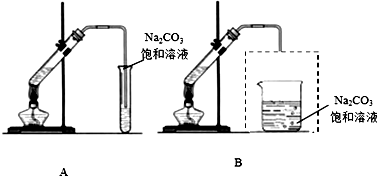
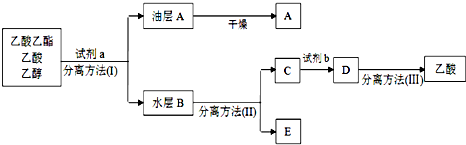
查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | ④ | ⑤ | |||||
| 3 | ① | ② | ⑥ | ⑦ | ⑧ | |||
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
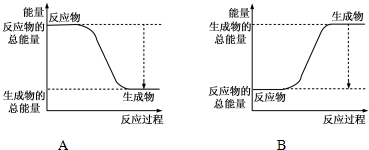
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
查看答案和解析>>
科目: 来源: 题型:解答题
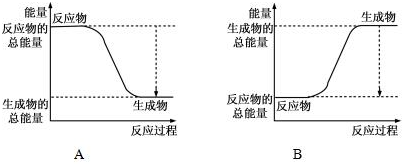
| 化学键 | H-H | O=O | H-O |
| 键能kJ/mol | 436 | 496 | 463 |
查看答案和解析>>
科目: 来源: 题型:解答题
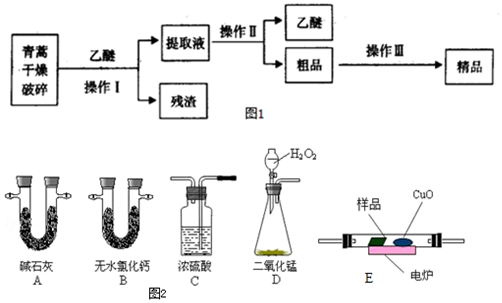
查看答案和解析>>
科目: 来源: 题型:实验题
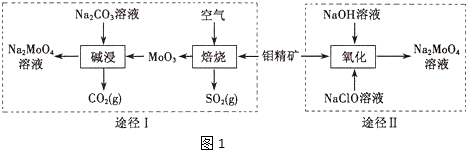
查看答案和解析>>
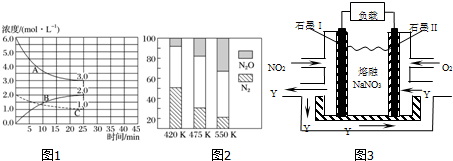
科目: 来源: 题型:选择题
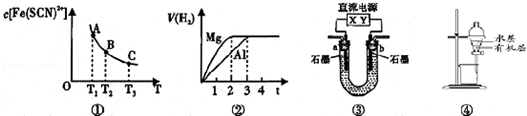
| A. | 已知图①是体系Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)中的c[Fe(SCN)2+]与温度T的平衡图象,A点与B点相比,A点的c(Fe3+)更小 | |
| B. | 图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 | |
| C. | 图③直流电源Y极为正极,U形管中为AgNO3溶液,则b管中电极反应式是:4OH--4e-═O2↑+2H2O | |
| D. | 图④表示分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目: 来源: 题型:解答题
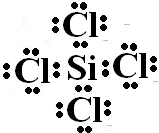 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com