
科目: 来源: 题型:实验题
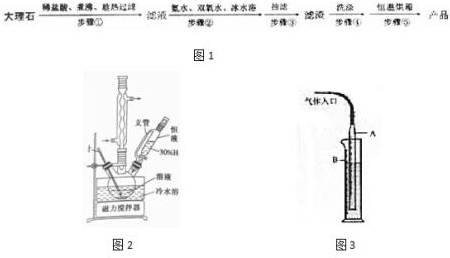
| 测定次数 | 收集前读数/mL | 收集后读数/mL |
| 第1次 | 21.06 | 4.24 |
| 第2次 | 23.52 | 6.72 |
| 第3次 | 22.41 | 5.63 |
| 第4次 | 20.80 | 7.20 |
查看答案和解析>>
科目: 来源: 题型:解答题
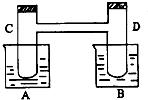 如图所示,在烧杯A中盛有20℃,50毫升水,B中盛有1摩/升盐酸50毫升,试管C、D相通,其中盛有红棕色气体,它处于下列平衡状态,2NO2?N2O4(△H<0,放热).当向A中加入50克硝酸铵使其溶解,往B中加入2克苛性钠,也使其溶解时,问:(注:硝酸铵溶于水吸热)
如图所示,在烧杯A中盛有20℃,50毫升水,B中盛有1摩/升盐酸50毫升,试管C、D相通,其中盛有红棕色气体,它处于下列平衡状态,2NO2?N2O4(△H<0,放热).当向A中加入50克硝酸铵使其溶解,往B中加入2克苛性钠,也使其溶解时,问:(注:硝酸铵溶于水吸热)查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 达到化学平衡时,4 v正(O2)=5 v逆(NO) | |
| B. | 若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 | |
| C. | 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 达到平衡时,若减小容器体积,则NH3的转化率会增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题:
肼(N2H4)广泛用于火箭推进剂、有机合成及电池燃料.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
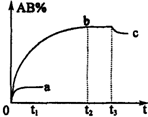 反应A2+B2?2AB;△H=Q,在不同温度和压强改变的条件下,产物AB的质量分数AB%生成情况如图:a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间t3开始向容器中加压的情况.则下列叙述正确的是( )
反应A2+B2?2AB;△H=Q,在不同温度和压强改变的条件下,产物AB的质量分数AB%生成情况如图:a为500℃时的情况;b为300℃时的情况;c为反应在300℃时从时间t3开始向容器中加压的情况.则下列叙述正确的是( )| A. | A2、B2及AB均为气体,Q>0 | |
| B. | AB为气体,A2、B2中至少有一种为非气体,Q<0 | |
| C. | AB为气体,A2、B2中有一种为气体,Q<0 | |
| D. | AB为固体,A2、B2中有一种为非气体,Q>0 |
查看答案和解析>>
科目: 来源: 题型:解答题
| t/K | 300 | 400 | 500 | … |
| K/(mol•L-1)2 | 4×106 | 8×107 | K1 | … |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 物质A的转化率小了 | B. | 平衡向正反应方向移动了 | ||
| C. | 物质B的质量分数减小了 | D. | b>a |
查看答案和解析>>
科目: 来源: 题型:解答题
| N2+3H2?2NH3 | ||||
| 温度 | 25℃ | 200℃ | 400℃ | 600℃ |
| 平衡常数K | 5×108 | 650 | 0.507 | 0.01 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com