
科目: 来源: 题型:多选题
| A. | 加压 | B. | 加入NaF晶体 | C. | 通入SO2气体 | D. | 加入NaI晶体 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
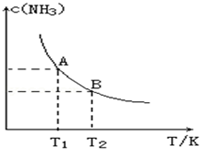 在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.
在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 反应达到平衡后,NO的反应速率保持恒定 | |
| C. | 使用高效催化剂只能提高正反应速率 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
查看答案和解析>>
科目: 来源: 题型:多选题
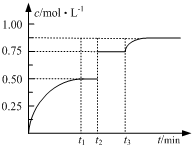 一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应:
一定温度下,将1mol A和1mol B气体充入2L恒容密闭容器,发生反应:| A. | 若t1=2,则反应在0~2 min内的平均速率为v(A)=0.50 mol•(L•min)-1 | |
| B. | 若t3时刻升高了温度,则该反应的△H>0 | |
| C. | 若t1时刻后向体系中加入A、B、C各1 mol,则υ(正)>υ(逆) | |
| D. | 温度不变,若起始向容器中加入1 mol A、1 mol B、2 mol D,则达平衡时A的转化率小于50% |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,出热量为a kJ | |
| B. | 因CuSO4•5H2O(s)=CuSO4(s)+5H2O(l)△H=+b kJ/mol,故1 mol CuSO4(s)溶于水时,放出热量b kJ | |
| C. | 因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(l)=2H2(g)+O2(g)△H=+c kJ/mol | |
| D. | 因N2(g)+3H2(g)?2NH3(g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2充分反应后,放出热量小于d kJ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H+(aq)+OH-(aq)=H2O(l)△H=-a kJ/mol,故1 mol NaOH固体与足量的稀盐酸反应,放出热量为a kJ | |
| B. | 因CuSO4•5H2O(s)=CuSO4(s)+5H2O(1)△H=+b kJ/mol,故1 mol CuSO4( s)溶于足量水时,放出热量为b kJ | |
| C. | 因氢气的燃烧热为c kJ/mol,故电解水的热化学方程式为:2H2O(1)=2H2( g)+O2( g)△H=+c kJ/mol | |
| D. | 因N2( g)+3H2( g)?2NH3( g)△H=-d kJ/mol,故在某容器中投入1 mol N2与3 mol H2 充分反应后,放出热量小于d kJ |
查看答案和解析>>
科目: 来源: 题型:多选题
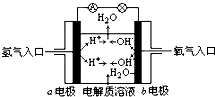
| A. | b电极是负极 | |
| B. | 总反应方程式为:2H2+O2═2H2O | |
| C. | 负极发生还原反应,正极发生氧化反应 | |
| D. | 氢氧燃料电池是一种具有广泛应用前景的绿色电源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com