
科目: 来源: 题型:多选题
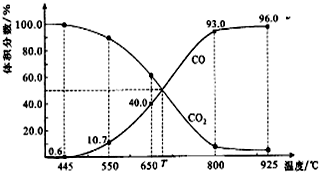
| A. | 550℃时,若充入惰性气体,v正,v逆均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动 | |
| D. | 该反应为吸热反应 |
查看答案和解析>>
科目: 来源: 题型:填空题
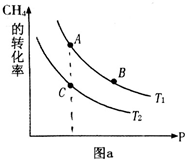 氢气、甲醇是优质的清洁燃料,可制作燃料电池.
氢气、甲醇是优质的清洁燃料,可制作燃料电池.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
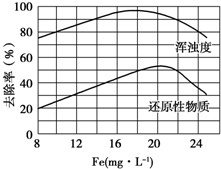 FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小.请回答下列问题:
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小.请回答下列问题:查看答案和解析>>
科目: 来源: 题型:实验题
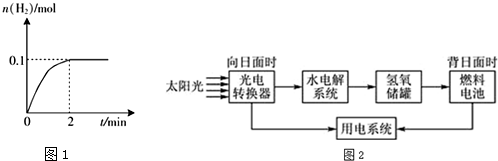
查看答案和解析>>
科目: 来源: 题型:推断题
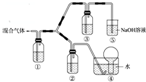 A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$倍;C与E同主族.
A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的$\frac{3}{4}$倍;C与E同主族.查看答案和解析>>
科目: 来源: 题型:填空题
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目: 来源: 题型:实验题
| t/s | 0 | 500 | 1000 |
| c(N2O5/mol/L) | 5.00 | 3.50 | 2.50 |
查看答案和解析>>
科目: 来源: 题型:解答题
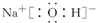 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com