
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
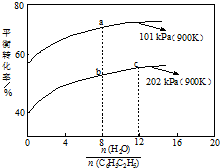 苯乙烯(C8H8)是生产各种塑料的重要单体,其制备原理是:
苯乙烯(C8H8)是生产各种塑料的重要单体,其制备原理是:| A. | a点转化率为75%,若起始向1 L恒容容器中充入1 mol 乙苯,则平衡常数为2.25 | |
| B. | b点转化率为50%,则混合气体中苯乙烯的体积分数为$\frac{1}{19}$ | |
| C. | 恒容时加入稀释剂能减小C8H10 (g)平衡转化率 | |
| D. | b点和c点温度和压强相同,所以反应速率也相等 |
查看答案和解析>>
科目: 来源: 题型:解答题
 请回答下列问题:
请回答下列问题:查看答案和解析>>
科目: 来源: 题型:解答题
| 化学式 | H2(g) | CO(g) | CH3OH(l) |
| 标准燃烧热(25℃) △H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
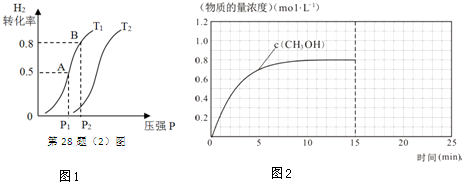
查看答案和解析>>
科目: 来源: 题型:解答题
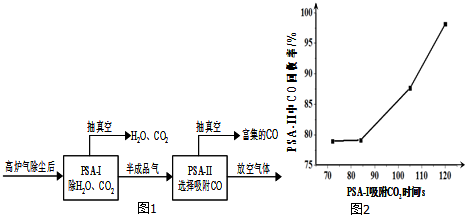
查看答案和解析>>
科目: 来源: 题型:解答题
| 方法1 | 用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4 |
| 方法2 | 用水煤气(主要成分为CO、H2等)将SO2在高温下还原成单质硫 |
| 方法3 | 用Na2SO3溶液吸收SO2转化为NaHSO3,再经电解转化为H2SO4 |
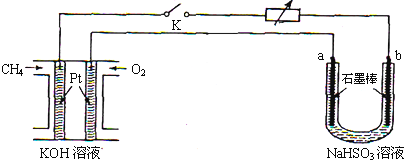
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 逆反应速率增大,正反应速率减小,平衡向逆反应方向移动 | |
| B. | 逆反应速率减小,正反应速率增大,平衡向正反应方向移动 | |
| C. | 正、逆反应速率都增大,平衡向正反应方向移动 | |
| D. | 正、逆反应速率都减小,平衡向逆反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:解答题
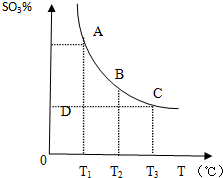 运用化学原理研究元素及其化合物的反应有重要意义.
运用化学原理研究元素及其化合物的反应有重要意义.查看答案和解析>>
科目: 来源: 题型:解答题
| 化学反应 | 平衡 常数 | 温度/℃ | ||
| 500 | 700 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.34 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 1.70 | 2.52 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | |||
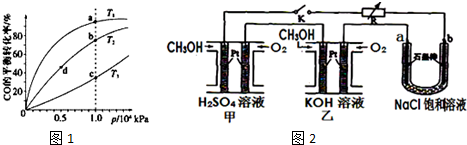
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com