
科目: 来源: 题型:解答题
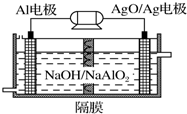 铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛.查看答案和解析>>
科目: 来源: 题型:解答题
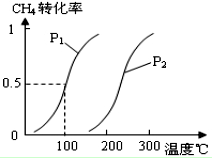 甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇.| 实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
| I | 150 | 1/3 | 0.1 |
| II | 5 | ||
| III | 350 | 5 |
查看答案和解析>>
科目: 来源: 题型:解答题
 短周期元素Q、R、T、W在元素周期表中位置如图所示,其中T所处的周期序数与主族序数相等,
短周期元素Q、R、T、W在元素周期表中位置如图所示,其中T所处的周期序数与主族序数相等, ,R的最简单氢化物的电子式为
,R的最简单氢化物的电子式为 ,Q的1:1型氢化物中相对分子质量最小的分子是直线型分子(立体构型).
,Q的1:1型氢化物中相对分子质量最小的分子是直线型分子(立体构型).查看答案和解析>>
科目: 来源: 题型:解答题
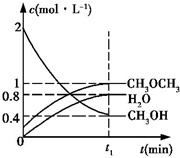 二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1
二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成二甲醚的热化学方程式为:3H2(g)+3CO(g)?CH3OCH3(g)+CO2(g)△H=-274kJ•mol-1查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 加水时,平衡向逆反应方向移动 | |
| B. | 通入少量HCl,平衡向正反应方向移动 | |
| C. | 加入少量0.1mol/LNaOH,溶液中c(OH-)减小 | |
| D. | 加入少量NH4Cl固体,平衡向逆反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
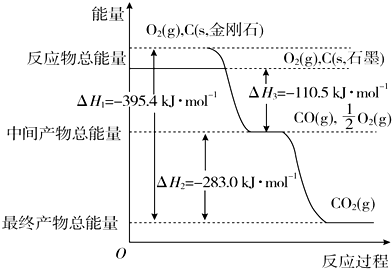
查看答案和解析>>
科目: 来源: 题型:选择题
| 容器 | 温度/k | 物质的起始浓度/mol•L-1 | 物质的平衡浓度/mol•L-1 | ||
| c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
| Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
| Ⅱ | 400 | 0.40 | 0.20 | 0 | |
| Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
| A. | 该方应的正反应吸热 | |
| B. | 达到平衡时,容器Ⅰ中反应物转化率比容器Ⅱ中的大 | |
| C. | 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍 | |
| D. | 达到平衡时,容器Ⅲ中的反应速率比容器Ⅰ中的大 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com