
科目: 来源: 题型:解答题
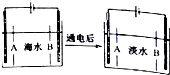 南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验:
南海诸岛是我国固有领土,但多数岛上淡水资源匮乏,为检验某岛上泉水是否达标,取样品对其进行检验:查看答案和解析>>
科目: 来源: 题型:解答题
 N、C、S元素的单质及化合物在工农业生成中有着重要的应用
N、C、S元素的单质及化合物在工农业生成中有着重要的应用| t/min | n(CO)/mol | n(Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
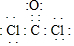
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锅炉水垢中的CaSO4经饱和碳酸钠溶液浸泡可转化为CaCO3 | |
| B. | 常温下,在含有Ag+和Cl-的溶液中,Ag+和Cl-浓度之积是个常数 | |
| C. | 当醋酸达到电离平衡后,改变某条件电离平衡向正反应方向移动,则溶液的导电能力一定变强 | |
| D. | 将浓度为0.1 mol/L的HF溶液加水不断稀释,溶液$\frac{c({F}^{-})}{c({H}^{+})}$始终保持增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 时间/min SO2质量/10-3g 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
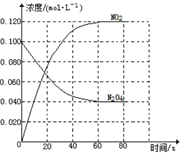
查看答案和解析>>
科目: 来源: 题型:选择题
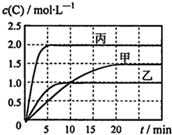 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+хB(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中物质C的浓度随时间变化关系分别用表和图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T3 |
| 反应物起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | 达平衡时A(g)的浓度:乙=丙>甲 | |
| B. | 甲容器中达平衡时B(g)的转化率为75% | |
| C. | 温度分别为T1、T2时,该反应的平衡常数:K(T1)<K(T2) | |
| D. | 丙容器中达到平衡后,若同时向容器中再充入1mol A(g)、1mol B(g)、1molC(g),则平衡向逆反应方向移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(Ag+) | B. | $\frac{c(C{l}^{-})}{c(B{r}^{-})}$ | C. | c(Cl-) | D. | $\frac{c(A{g}^{+})•c(B{r}^{-})}{c(C{l}^{-})}$ |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.
碳是形成物种最多的元素之一,许多含碳物质对人类极其重要.| 时间/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com