
科目: 来源: 题型:解答题
| 共价键 | H-H | N≡N | N-H |
| 键能(kJ•mol-1) | 436 | 945 | 391 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Hg(l)+H2SO4(aq)═HgSO4(aq)+H2(g)常温下不能自发进行,说明△H<0 | |
| B. | 用惰性电极电解1L1mol/L的CuSO4溶液,当阴极析出3.2 g铜时,加入0.05 molCu(OH)2固体可将溶液恢复至原浓度 | |
| C. | 已知25℃时,Ksp(AgCl)=1.8×10-10、Ksp(Ag2CrO4)=2.0×10-12,所以AgCl溶解度大于Ag2CrO4溶解度 | |
| D. | 25℃时,向0.1 mol/L CH3COOH溶液中加入少量CH3COONa固体,该溶液中水的电离程度将增大,且Kw不变 |
查看答案和解析>>
科目: 来源: 题型:多选题
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A. | 反应在t1 min内的平均速率为v(H2)=$\frac{0.40}{{t}_{1}}$mol/(L•min) | |
| B. | 保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2,到达平衡时,n(CO2)=0.40 mol | |
| C. | 保持其他条件不变,向平衡体系中再通入0.20 mol CO,与原平衡相比,达到新平衡时CO转化率减小,H2的体积分数也减小 | |
| D. | 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
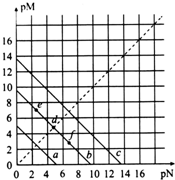 已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )
已知:T℃时,Ksp(CaSO4)=4.90×10-5、Ksp(CaCO3)=2.8×10-9、Ksp(PbCO3)=8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )| A. | a线代表的是PbCO3 | |
| B. | T℃时,向10 mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+):c(Pb2+)=3×10-5 | |
| C. | T℃时,向CaSO4沉淀中加入1 mol/L的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀 | |
| D. | T℃时,向CaCO3悬浊液中加入NH4Cl固体,会使图象中d点向f点转化 |
查看答案和解析>>
科目: 来源: 题型:解答题
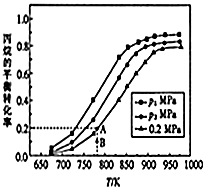 丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:
丙烯(C3H6)是制造聚丙烯、丙烯腈等化工产品的原料.目前正在开发丙烷(C3H8)裂解制取丙烯,其原理为C3H8(g)?C3H6(g)+H2(g)△H.回答下列问题:| 共价键 | C-C | C=C | C-H | H-H |
| 键能/KJ•mol-1 | 348 | 615 | 413 | 436 |
| n(CO2)/n(C3H8)温度/K | 600 | 700 | 800 | 900 | 1000 |
| 0:1 | 1.0% | 6.3% | 24.4% | 59.6% | 87.0% |
| 1:1 | 2.7% | 12.9% | 41.6% | 78.0% | 94.5% |
| 1:2 | 3.7% | 17.2% | 50.9% | 85.3% | 97.1% |
| 1:3 | 4.0% | 20.5% | 57.7% | 89.5% | 98.2% |
查看答案和解析>>
科目: 来源: 题型:解答题
| CO体积分数% 投料比 | 温度/℃ | ||||
| 200 | T2 | T3 | T4 | ||
| $\frac{n({H}_{2}0)}{n(C0)}$ | 1 | 1.70 | 2.73 | 6.00 | 7.85 |
| 3 | 0.21 | 0.30 | 0.84 | 1.52 | |
| 5 | 0.02 | 0.06 | 0.43 | 0.80 | |
查看答案和解析>>
科目: 来源: 题型:解答题
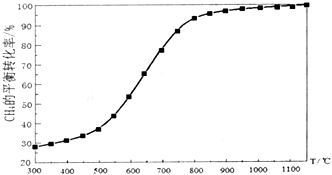 合成气(C0+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品.
合成气(C0+H2)在煤化工和天然气化工中有着十分重要的地位,由合成气可合成多种有机基础原料和产品.| 碳氧比[$\frac{n(C{H}_{4})}{n({O}_{2})}$] | 1:0.25 | 1:0.5 | 1:1 | 1:1.25 |
| CH4转化率 | 0.40 | 0.88 | 0.98 | 0.99 |
| H2选择性 | 0.98 | 0.93 | 0.67 | 0.40 |
| CO选择性 | 0.99 | 0.94 | 0.65 | 0.32 |
查看答案和解析>>
科目: 来源: 题型:选择题
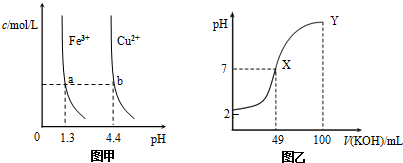
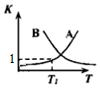
| A. | 由图甲知:Ksp[Fe(OH)3]<Ksp[Cu(OH)2] | |
| B. | 由图甲知:a、b点溶液中Kw,b点的大 | |
| C. | 由图乙知:HA为强酸 | |
| D. | 由图乙知:Y点对应的溶液中c(K+)>c(A-)>c(OH-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 达到平衡时,c(Pb2+)=c(Fe2+) | |
| B. | Ksp(FeS)大于Ksp(PbS) | |
| C. | 该反应的平衡常数K=$\frac{{K}_{sp}(FeS)}{{K}_{sp}(PbS)}$ | |
| D. | 溶液中加入少量Na2S固体后,c(Fe2+)减小 |
查看答案和解析>>
科目: 来源: 题型:解答题
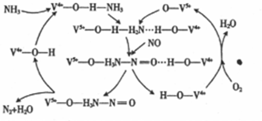

 | c(NH3)/mol•L-1 | c(O2)/mol•L-1 | c(NO)mol•L-1 |
| 0 | 1.2 | 1.75 | 0 |
| 4min | 0.4 | 0.75 | 0.8 |
| 6min | 0.4 | 0.75 | 0.8 |
| 8min | 0.6 | 1 | 0.6 |
| 9min | 0.6 | 1 | 0.6 |
| 10min | 1.05 | 1 | 1.05 |
| 12min | … | … | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com