
科目: 来源: 题型:解答题
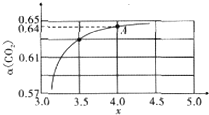 尿素作为一种中性肥料,适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.
尿素作为一种中性肥料,适用于各种土壤和植物.它易保存,使用方便,对土壤的破坏作用小,是目前使用量较大的一种化学氮肥.查看答案和解析>>
科目: 来源: 题型:推断题
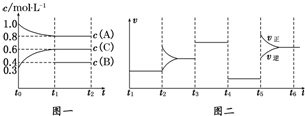
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向溶液中滴加Na2CO3溶液,立即产生沉淀和气体 | |
| B. | 若C(Cl-)=0.07mol/L,则溶液的PH为2 | |
| C. | 往溶液中加入NaOH溶液,先生成的沉淀呈红褐色 | |
| D. | 往溶液中通入NH3,直至溶液呈中性,此时溶液中C(NH4+)═C(Cl-) |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:实验题
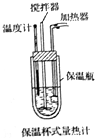 化学反应过程中总是伴随着能量的变化,能量间可以相互转化.
化学反应过程中总是伴随着能量的变化,能量间可以相互转化.查看答案和解析>>
科目: 来源: 题型:填空题
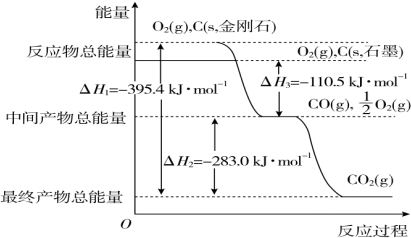
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com