
科目: 来源: 题型:解答题
 向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向.
向大气中排放过量的二氧化碳是造成全球气候变暖的重要因素,所以二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向. ;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.
;将足量的C02通入下列溶液中,最终溶液变浑浊的是ce.查看答案和解析>>
科目: 来源: 题型:解答题

| 压强/MPa C% 速度/℃ | 0.1 | 10 | 20 |
| 200 | 15.3 | 81.5 | 86.4 |
| 300 | 2.2 | a | 64.2 |
| 400 | 0.4 | 25.1 | 38.2 |
| 500 | 0.1 | 10.6 | 19.1 |
查看答案和解析>>
科目: 来源: 题型:选择题
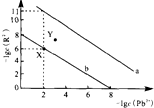 25℃时,PbR(R2-为SO42-或CO32-)的沉淀溶解平衡曲线如图.已知Ksp(PbCO3)<Ksp(PbSO4),下列说法不正确的是( )
25℃时,PbR(R2-为SO42-或CO32-)的沉淀溶解平衡曲线如图.已知Ksp(PbCO3)<Ksp(PbSO4),下列说法不正确的是( )| A. | 曲线a表示PbCO3 | |
| B. | 以PbSO4、Na2CO3和焦炭为原料可制备Pb | |
| C. | 当PbSO4和PbCO3沉淀共存时,溶液中$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$=105 | |
| D. | 向X点对应的饱和溶液中加入少量Pb(NO3)2,可转化为Y点对应的溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| Ag2SO4 | FeS | CuS | Ag2S | |
| Ksp | 1.2×10-5 | 6.3×10-18 | 8.5×10-45 | 6.3×10-50 |
| A. | 相同温度下,Ag2SO4、FeS、CuS饱和溶液中:c(Cu2+)>c(Fe2+)>c(Ag+) | |
| B. | 向FeS悬浊液中滴加CuSO4溶液发生反应的离子方程式:S2-+Cu2+=CuS↓ | |
| C. | 浓度均为0.004mol•L-1的AgNO3和H2SO4溶液等体积混合后不能产生沉淀 | |
| D. | 向饱和Ag2S溶液中加少量Na2S固体,溶液中c(Ag+)不变 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:多选题
| 化学式 | pKsp | pH | |
| 开始沉淀时 | 沉淀完全时 | ||
| Mg(OH)2 | / | 10.8 | 13.3 |
| Cu(OH)2 | / | 4.4 | / |
| Fe(OH)3 | / | 1.5 | / |
| Al(OH)3 | 33 | / | / |
| A. | Mg(OH)2不溶于pH=7的CH3COONH4溶液 | B. | PKsp[Mg(OH)2]>PKsp[Cu(OH)2] | ||
| C. | Fe(OH)3的PKsp=38.5 | D. | Al3+在溶液中沉淀完全的pH=5 |
查看答案和解析>>
科目: 来源: 题型:选择题
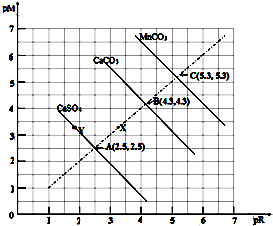
| A. | MnCO3在常温下的Ksp=2.5 x10-11(已知100.4=2.5) | |
| B. | 三种物质在常温下的溶解度大小顺序为MnCO3>CaCO3>CaSO4 | |
| C. | 处于Y点的CaSO4溶液中c(Ca2+)>c(SO42-) | |
| D. | Ca2+、CO32-浓度为X点的溶液可通过蒸发溶剂变为B点的溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
 某学生探究AgCl、Ag2S沉淀转化的原因.
某学生探究AgCl、Ag2S沉淀转化的原因.| 步 骤 | 现 象 |
| Ⅰ.将NaCl与AgNO3溶液混合 | 产生白色沉淀 |
| Ⅱ.向所得固液混合物中加Na2S溶液 | 沉淀变为黑色 |
| Ⅲ.滤出黑色沉淀,加入NaCl溶液 | 较长时间后,沉淀变为乳白色 |
| 现象 | B.一段时间后,出现白色沉淀 |
| C.一点时间后,无明显变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com