
科目: 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ①③④ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 加入少量CuSO4溶液 | B. | 加入少量K2SO4溶液 | ||
| C. | 加入少量的Na2CO3溶液 | D. | 将稀硫酸换为浓硫酸 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ① | B. | ②③④ | C. | ①②④ | D. | ①②⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
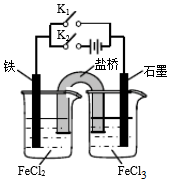
| A. | 闭合K1断开K2,左侧烧杯中的FeCl2溶液浓度逐渐增大 | |
| B. | 闭合K2断开K1,左侧烧杯中的Fe2+向铁电极移动 | |
| C. | 闭合K1断开K2,电流从石墨电极经过K1流向铁电极 | |
| D. | 无论闭合K1断开K2,还是断开K1闭合K2,石墨电极上发生的反应都是Fe3++e-=Fe2+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 当温度一定时,不同的起始条件下可逆反应建立平衡状态时,平衡常数和转化率一定是定值 | |
| B. | 依据焓判据:NH4HCO3受热分解可自发进行 | |
| C. | 大多数化学反应在一定条件下都有一定的限度 | |
| D. | FeCl3与KSCN反应达到平衡时,向其中滴加少量KCl溶液,则溶液颜色变深 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:实验题
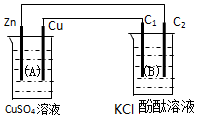 按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题.
按如图装置进行实验,图中C1、C2均为石墨棒.请回答下列问题.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2、O2、SO3中 | B. | SO3中 | C. | SO2、O2中 | D. | SO2、SO3中 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com