
科目: 来源: 题型:解答题
 根据组成原电池的条件,试以反应:2Fe3++Cu=2Fe2++Cu2+设计一个原电池,
根据组成原电池的条件,试以反应:2Fe3++Cu=2Fe2++Cu2+设计一个原电池,查看答案和解析>>
科目: 来源: 题型:填空题
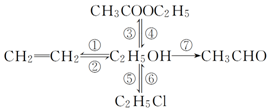 写出下列各物质相互转化的化学方程式,并说明各步的反应类型.
写出下列各物质相互转化的化学方程式,并说明各步的反应类型.查看答案和解析>>
科目: 来源: 题型:推断题
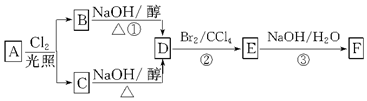
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用CH3COOH 溶液做导电性实验,灯泡很暗,能证明 CH3COOH 是弱电解质 | |
| B. | 将Ca(OH)2的饱和溶液加热,pH 和 Kw均增大 | |
| C. | 25℃时,1.0×10-3mol•L-1盐酸的pH=3.0,1.0×10-8 mol•L-1盐酸的pH=8.0 | |
| D. | 向pH相同的氨水和氢氧化钠溶液中分别加入适量NH4Cl(s)后,两溶液的pH均减小 |
查看答案和解析>>
科目: 来源: 题型:解答题
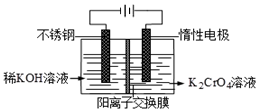 已知重铬酸钾(K2Cr2O7)是一种中学实验室常用的强氧化剂.重铬酸钾溶液中存在以下平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙红色)+H2O.
已知重铬酸钾(K2Cr2O7)是一种中学实验室常用的强氧化剂.重铬酸钾溶液中存在以下平衡:2CrO42-(黄色)+2H+?Cr2O72-(橙红色)+H2O.查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:解答题
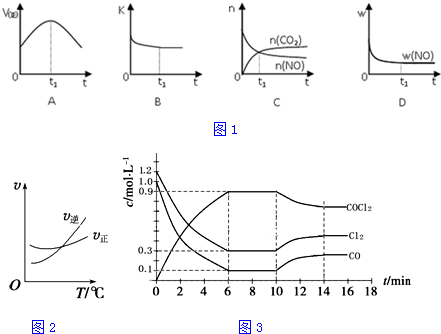
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| t/min | 0 | 20 | 40 | 60 | 80 | 120 |
| X(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
| X(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com