
科目: 来源: 题型:实验题
| 应量取盐酸体积/ml | 应选用容量瓶的规格/ml | 除容量瓶外还需要的其它仪器 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
 (1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
(1)反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.查看答案和解析>>
科目: 来源: 题型:实验题

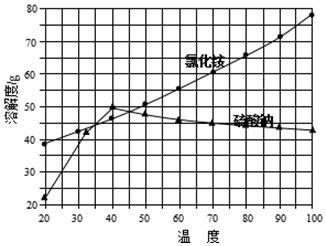
| 操作步骤 | 现象 | 结论 |
| 取少量氯化铵产品于试管底部,加热 | 如果试管底部没有固体剩余 | 表明氯化铵产品纯净 |
查看答案和解析>>
科目: 来源: 题型:实验题
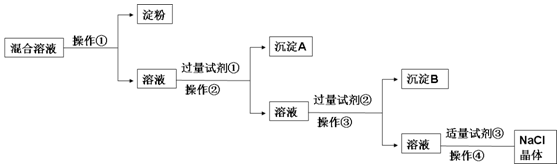
查看答案和解析>>
科目: 来源: 题型:填空题
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的 刻度(mL) | ||
| 第①次 | 10.00 | 0.40 | 20.50 |
| 第②次 | 10.00 | 4.10 | 24.00 |
| 第③次 | 10.00 | 2.20 | 23.80 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol任何物质所含有的原子数都相同 | |
| B. | 摩尔是物质的量的单位,简称摩,符号为mol | |
| C. | 摩尔可以把物质的宏观数量与微观粒子的数量联系起来 | |
| D. | 国际上规定,0.012 kg C中所含有的碳原子数目为1摩 |
查看答案和解析>>
科目: 来源: 题型:选择题
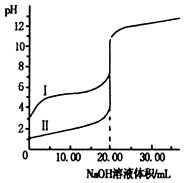 室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )
室温下,用0.1mol•L-1 NaOH溶液分别滴定20.00ml0.1mol•L-1的盐酸和醋酸溶液,滴定曲线如图.下列说法正确的是( )| A. | I、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | V(NaOH)=10.00mL时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$>1 | |
| C. | pH=7时,两种酸所消耗NaOH溶液的体积相等 | |
| D. | V(NaOH)=20.00mL时,c(Cl一)<c(CH3COO一) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com