
科目: 来源: 题型:计算题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 4.2 g CO | B. | 6.6 g CO2 | C. | 8 g SO2 | D. | 9.8 g H2SO4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| D. | 大气中二氧化碳含量的增多是造成“温室效应”的主要原因 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  | B. | 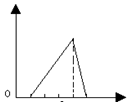 | C. | 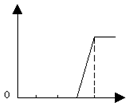 | D. | 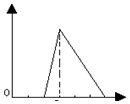 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应不是氧化还原反应 | B. | 氮气只是氧化产物 | ||
| C. | N2O4是还原剂 | D. | N2O4是氧化剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SO2+2H2S═S+2H2O | B. | 2NaNO3$\frac{\underline{\;\;△\;\;}}{\;}$2NaNO2+O2↑ | ||
| C. | NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$N2O↑+2H2O | D. | 3Cl2+6KOH═5KCl+KClO3+3H2O |
查看答案和解析>>
科目: 来源: 题型:实验题
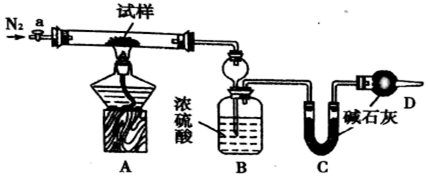
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com