
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Al2(SO4)3═2Al3++3SO42- | B. | FeCl2═Fe2++3Cl- | ||
| C. | H2SO4═H2++SO42- | D. | Ca(OH)2═Ca2++2(OH-) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
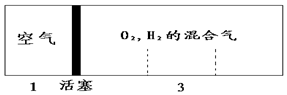 密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为( )
密闭容器中自由移动的活塞两边分别充入空气和H2、O2的混合气体,开始体积比为1:3,若将H2、O2的混合气体点燃引爆,恢复到原来温度(水为液态),活塞右滑停留于容器的正中央,则原来H2、O2的体积比可能为( )| A. | 1:2 | B. | 3:2 | C. | 5:2 | D. | 7:2 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com