
科目: 来源: 题型:选择题
| A. | p (Ne)>p (H2)>p (O2) | B. | p (O2)>p (Ne)>p (H2) | C. | p (H2)>p (O2)>p (Ne) | D. | p (H2)>p (Ne)>p (O2) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀 | |
| B. | 水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染 | |
| C. | 清晨,在茂密的树林中,常常可以看到枝叶间透过的一道道光线 | |
| D. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |
查看答案和解析>>
科目: 来源: 题型:实验题
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓H2SO4,B中盛有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中盛有浓H2SO4,B中盛有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溶液中含有1mol Na2SO4 | B. | 1mol Na2SO4溶于1L水中 | ||
| C. | 溶液中c(Na+)=2 mol•L-1 | D. | 1L溶液中含有2molNa+,2mol SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 配制100mL该溶液需用5.85g NaCl | |
| B. | 该溶液的物质的量浓度为1mol•L -1 | |
| C. | 该溶液中含有58.5g NaCl | |
| D. | 量取100mL该溶液,其中Na+的物质的量为0.1mol |
查看答案和解析>>
科目: 来源: 题型:推断题
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念.
2010年亚运会在我国广州成功举办,整个亚运会体现了环保理念.查看答案和解析>>
科目: 来源: 题型:解答题
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系压强(Pa) | p1 | p2 | p3 |
| 反应物转化率 | α1 | α2 | α3 |
查看答案和解析>>
科目: 来源: 题型:解答题
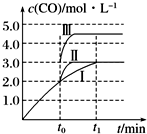 工业上可用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:
工业上可用CO或CO2来生产燃料甲醇.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下表所示:| 化学反应 | 平衡 常数 | 温度/℃ | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com