
科目: 来源: 题型:解答题
| 时间/s n/mol | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 比较项 | 依据的化学反应事实 | |
| A | 比较Cl和S的非金属性 | Na2S+2HCl=2NaCl+H2S↑ |
| B | 比较Fe2+和Br-的还原性 | 2FeBr2+3Cl2(过量)=2FeCl3+2Br2 |
| C | 比较氯化银和碘化银溶解度 | AgCl(s)+I-少量(aq)=AgI(s)+Cl-(aq) |
| D | 比较硝酸和硫酸的酸性 | 3Cu+8HNO3(稀)═3Cu(NO3)2+4H2O+2NO↑ Cu和H2SO4(稀)不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
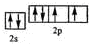 ,该元素的名称是氧;
,该元素的名称是氧;查看答案和解析>>
科目: 来源: 题型:推断题
查看答案和解析>>
科目: 来源: 题型:解答题
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 2.00 | 0.00 |
| 1 | 0.90 | 1.80 | 0.20 |
| 3 | 0.75 | 1.50 | 0.50 |
| 5 | 0.65 | 1.30 | 0.70 |
| 9 | 0.55 | 1.10 | 0.90 |
| 10 | 0.55 | 1.10 | 0.90 |
| 14 | 0.55 | 1.10 | 0.90 |
 2Z
2Z查看答案和解析>>
科目: 来源: 题型:选择题
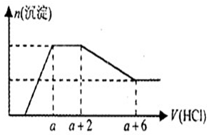 某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )
某溶液中可能含有OH-,CO32-,AlO2-,SiO32-,SO42-,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示.下列判断正确的是( )| A. | 原溶液中一定含有Na2SO4 | |
| B. | 反应后形成的溶液溶质为NaCl | |
| C. | 原溶液中含有CO32-与AlO2-的物质的量比为1:1 | |
| D. | 原溶液中一定含有的离子是OH-,CO32-,SiO32-,AlO2- |
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
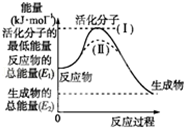 I.请认真观察图,然后回答问题.
I.请认真观察图,然后回答问题.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 能发生取代、加成、氧化、加聚等反应 | |
| B. | 1mol该物质能和2molNaOH反应 | |
| C. | 1mol该物质与Br2等物质的量加成可得到三种产物 | |
| D. | 它与足量H2反应可得分子式为C8H18O3的物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com