
科目: 来源: 题型:选择题
| A. | 烧菜用过的铁锅,经放置常出现红棕色斑迹 | |
| B. | 用煤气灶燃烧天然气为炒菜提供热量 | |
| C. | 牛奶久置空气中变质腐败 | |
| D. | 向沸水中滴入FeCl3饱和溶液,适当加热,制备胶体 |
查看答案和解析>>
科目: 来源: 题型:实验题
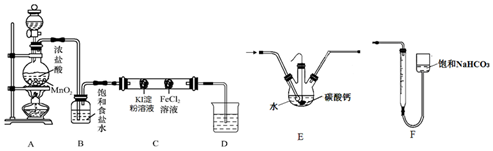
查看答案和解析>>
科目: 来源: 题型:实验题


查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe2+、Na+、NO3-、Cl- | B. | Mg2+、NH4+、SO42-、NO3- | ||
| C. | H+、K+、Cl-、CH3COO- | D. | K+、Mg2+、CO32-、OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1个 | B. | 2个 | C. | 3个 | D. | 5个 |
查看答案和解析>>
科目: 来源: 题型:解答题
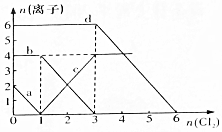 已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:
已知Cl-、Br-、Fe2+、I-的还原性依次增强.现向FeBr2、FeI2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示,请回答:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2+H2O=H2CO3 | B. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CO2↑+CaO | ||
| C. | CaCO3+2HCl=CaCl2+H2O+CO2↑ | D. | 2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$NaCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 从环境保护角度,氟氯代烷不宜用作制冷剂 | |
| B. | 聚氯乙烯制品适宜用于直接盛装食物 | |
| C. | 苯、甲苯、二甲苯都是基本的有机化工原料 | |
| D. | 乙烯用作果实催熟剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸溶液与氢氧化钡溶液:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | 盐酸与碳酸钠溶液反应CO32-+2H+═CO2↑+H2O | |
| C. | 硝酸银溶液中加入铜粉Ag++Cu═Cu2++Ag | |
| D. | 铁与稀盐酸反应2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com