
科目: 来源: 题型:实验题

 ,在该反应中浓盐酸表现了还原性和酸性.
,在该反应中浓盐酸表现了还原性和酸性.查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 说法1 | 说法2 | 判断 |
| A | Na+、Mg2+、O2-、F-中离子半径最大的是O2- | I的原子半径大于Br,HI比HBr的热稳定性强 | 说法1说法2均正确 |
| B | P的非金属性强于Si,H3PO4比H2SiO3的酸性强 | 热稳定性:HCl>HI | 说法1说法2均正确 |
| C | 原子半径:Na>Mg | 酸性:H2SO3>H2SO4 | 说法1说法2均错误 |
| D | 同主族元素的简单阴离子还原性越强,水解程度越大 | 同周期金属元素的化合价越高,其原子失电子能力越强 | 说法1错误说法2正确 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
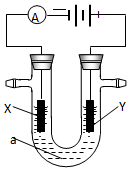 ( 1 )工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠,我国的氯碱工业大多采用离子交换膜电解槽.写出电解饱和氯化钠溶液时的电极反应和总的离子反应方程式:
( 1 )工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠,我国的氯碱工业大多采用离子交换膜电解槽.写出电解饱和氯化钠溶液时的电极反应和总的离子反应方程式:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
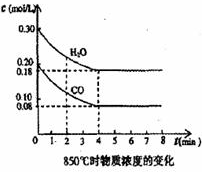 在一体积为 10L的密闭容器中,通入一定量的CO和H2O,在850℃发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图:
在一体积为 10L的密闭容器中,通入一定量的CO和H2O,在850℃发生如下反应:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0.CO和H2O浓度变化如图:查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com