
科目: 来源: 题型:解答题
 无机化合物可根据其组成和性质进行分类
无机化合物可根据其组成和性质进行分类| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 氢化物 |
| 化学式 | ①HCl②H2SO4 | ③NaOH ④Ba(OH)2 | ⑤Na2CO3 ⑥K2SO4 | ⑦CO2 ⑧Na2O | ⑨NH3 ⑩H2O2 |
查看答案和解析>>
科目: 来源: 题型:实验题
 Ⅰ.物质的量浓度相同的 ①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵 五种溶液中c(NH4+)大小的顺序是(填序号)⑤>④>②>③>①
Ⅰ.物质的量浓度相同的 ①氨水 ②氯化铵 ③碳酸氢铵 ④硫酸氢铵 ⑤硫酸铵 五种溶液中c(NH4+)大小的顺序是(填序号)⑤>④>②>③>①查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
| 温度(℃) | 220 | 330 | 440 | 550 | 660 | 770 | 880 |
| 铜平均溶解速率(×10-3mol•L-1•min-1) | 77.34 | 88.01 | 99.25 | 77.98 | 77.24 | 66.73 | 55.76 |
查看答案和解析>>
科目: 来源: 题型:解答题

| 温度(℃) | 20 | 40 | 60 | 80 | 100 |
| 石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
| 胆矾 | 32 | 44.6 | 61.8 | 83.8 | 114 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 电解NaCl饱和溶液,可制得金属钠 | |
| B. | 在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 | |
| C. | 寻找高效催化剂,利用太阳能分解水是制取氢气的较理想方法 | |
| D. | MgO的熔点很高,可用于制作耐高温材料 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
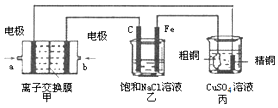
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 70℃,将0.1mol 镁粉加入到10mL6mol•L-1的硝酸溶液中 | |
| B. | 60℃,将0.2mol 镁粉加入到20mL3mol•L-1的盐酸溶液中 | |
| C. | 60℃,将0.1mol 镁粉加入到10mL3mol•L-1的硫酸溶液中 | |
| D. | 60℃,将0.2mol 铁粉加入到10mL3mol•L-1的盐酸溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com