
科目: 来源: 题型:解答题
| 温度/K | 反应I | 反应II | 已知: K2>K1>K2′>K1′ |
| 298 | K1 | K2 | |
| 398 | K1′ | K2′ |
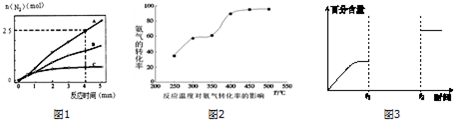
查看答案和解析>>
科目: 来源: 题型:实验题
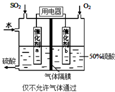 回答下列问题:
回答下列问题:查看答案和解析>>
科目: 来源: 题型:实验题

查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
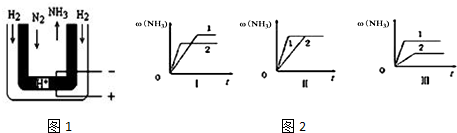
查看答案和解析>>
科目: 来源: 题型:实验题
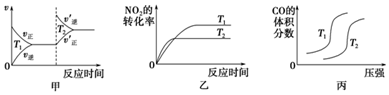
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
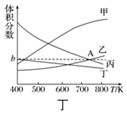
查看答案和解析>>
科目: 来源: 题型:实验题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 甲 | 乙 | 丙 | |
| 容积 | 1L | 1L | 0.5L |
| 起始加入物质 | X:2mol,Y:1mol | Z:2mol | X:0.5mol,Y:0.25mol |
| 平衡时 | c(Z)=1.2mol•L-1 | c(Z)=1.2mol•L-1 |
| A. | T℃时该反应的平衡常数K为3.75 | |
| B. | 平衡时,X转化率:甲<丙 | |
| C. | 若乙是绝热容器,则平衡时,c(Z)>1.2mol•L-1 | |
| D. | 前2min内,丙容器中用X表示的平均反应速率v(X)=0.6mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑. |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
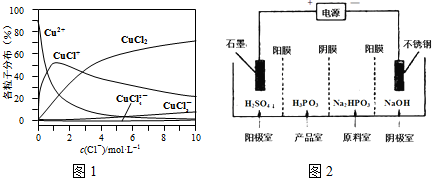
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com